
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| ${\;}_{19}^{40}$K | 19 | 21 | 19 | 40 |
| ${\;}_{18}^{38}$Ar | 18 | 20 | 19 | 38 |
| ${\;}_{16}^{32}$S2- | 16 | 16 | 18 | 32 |
分析 ${\;}_{Z}^{A}$X在该原子符号中左上角的A表示质量数,左下角的Z表示质子数,中子数=质量数-质子数,电子数=质子数,据此分析.
解答 解:${\;}_{19}^{40}$K中质子数为19,中子数=40-19=21,电子数=19,质量数=40;
质子数为18,则为Ar元素,质量数=18+20=38,其原子符号为${\;}_{18}^{38}$Ar,电子数=19;
质子数=质量数-中子数=32-16=16,则为S元素,其原子符号为${\;}_{16}^{32}$S,其电子数为18,则带有2个负电荷,其离子符号为${\;}_{16}^{32}$S2-;
故答案为:
| 微粒符号 | 质子数 | 中子数 | 电子数 | 质量数 |
| ${\;}_{19}^{40}$K | 19 | 21 | 19 | 40 |
| ${\;}_{18}^{38}$Ar | 18 | 20 | 19 | 38 |
| ${\;}_{16}^{32}$S2- | 16 | 16 | 18 | 32 |
点评 本题考查了原子中微粒之间的关系,题目难度不大,注意把握中子数=质量数-质子数,电子数=质子数.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 次序 | 稀盐酸(mL) | 余固体(g) |
| 1 | 先加入5.0mL | 1.32 |
| 2 | 再加入5.0mL | 0.64 |
| 3 | 再加入5.0mL | 0.20 |
| 4 | 再加入5.0mL | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③④ | C. | ①④⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ②③ | C. | ②③⑦ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
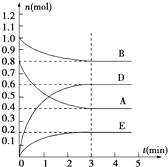 在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示:
在容积为2L的密闭容器内,T℃时发生反应:mA(g)+nB(g)?pD(g)+qE(s)△H<0(m、n、p、q为最简比例的整数)反应过程如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com