
分析 (1)根据使用托盘天平称量药品时应遵循“左物右码”,天平指针偏左,说明物品质量大于砝码质量来分析;
(2)根据Fe2+、Fe3+能发生水解;
(3)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器来解答;
(4)根据单质溴具有氧化性,能氧化Fe2+生成Fe3+;
(5)若坩埚质量是Wg,坩埚与最终灼烧后的固体总质量是W2 g则生成的氧化铁质量为(W2-W1)g,依据氧化铁化学式计算25ml溶液中铁元素质量,换算250ml中含有铁元素质量计算含量;
(6)根据杂质是否引起沉淀质量的变化来分析.
解答 解:(1)称量前,天平指针偏左,说明左盘质量大于右盘质量,称量读数时,指针刚好在标尺的中间,则所得样品的质量偏小,故选:B;
(2)Fe2+、Fe3+能发生水解,加入盐酸,原因是抑制Fe2+、Fe3+的水解,故答案为:抑制Fe2+、Fe3+的水解;
(3)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,
故答案为:玻璃棒、胶头滴管;
(4)单质溴具有氧化性,能氧化Fe2+生成Fe3+:2Fe2++Br2=2Fe3++2Br-,故答案为:2Fe2++Br2=2Fe3++2Br-;
(5)若坩埚质量是Wg,坩埚与最终灼烧后的固体总质量是W2 g则生成的氧化铁质量为(W2-W1)g,25ml溶液中铁元素的质量=$\frac{({W}_{2}-{W}_{1})112}{160}$,250ml中含有铁元素质量 $\frac{1120(W{\;}_{2}-W{\;}_{1)}}{160}$,所以铁元素质量分数=$\frac{1120(W{\;}_{2}-W{\;}_{1})}{160a}$×100%=$\frac{700(W{\;}_{2}-W{\;}_{1})}{a}$%,
故答案为:$\frac{700(W{\;}_{2}-W{\;}_{1})}{a}$%;
(6)①当含有NaCl时,沉淀质量的不变化,所以不影响结果,故答案为:不变;
②当含有Fe2(SO4)3时,沉淀质量的变大,所以铁元素的测定含量偏高,故答案为:偏高.
点评 本题主要考查了铁元素的质量分数的测定,同时考查了实验知识,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,Fe作负极,发生氧化反应 | |
| B. | 放电时,NiO2作正极,发生还原反应 | |
| C. | 蓄电池的电极应浸入碱性电解质溶液中 | |
| D. | 充电时,充电机的正极接在该蓄电池的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族金属元素是同周期中金属性最强的元素 | |
| B. | 非金属元素组成的化合物中只含共价键 | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | VIIA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL 3mol/L 的X溶液 | B. | 20mL 2mol/L 的X溶液 | ||
| C. | 10mL 4mol/L的X溶液 | D. | 10mL 2mol/L的X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当12NA个电子转移时,该反应放出1411 kJ的能量 | |
| B. | 当2NA个水分子生成且为液体时,放出1411 kJ的能量 | |
| C. | 当8NA个碳氧共用电子对生成时,放出1411 kJ的能量 | |
| D. | 当8NA个碳氧双键生成时,放出1411 kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳分子的结构式:O-C-O | |
| B. | 氢氧根离子的电子式: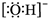 | |
| C. | 氯原子的结构示意图: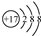 | |
| D. | 中子数为146、质子数为92 的铀(U)原子${\;}_{92}^{146}$U |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com