
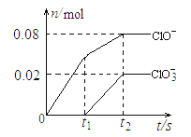
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。下列说法正确的是 ( )
A.苛性钾溶液中KOH的质量是15.68 g
B.反应中ClO3-的生成是因为Cl2通入过量
C.在酸性条件下 ClO- 和ClO3-可生成Cl2
D.一定有3.136 L氯气参与反应
【答案】A
【解析】
由图像知0~t1氯气和氢氧化钾发生反应生成KCl和KClO,t1~t2反应生成KCl、KClO和KClO3。且据电子守恒知每生成1molKClO同时生成1molKCl,每生成1mol KClO3同时生成5molKCl,所以生成了0.08molKClO和0.02mol KClO3,则生成了0.18molKCl。
A. 据钾原子守恒KOH的物质的量是产物中三种盐的物质的量之和为0.28mol,质量是15.68g,故A正确。
B. 由题意知氯气和苛性钾恰好反应,反应放热,所以生成KClO3是因为温度升高,故B错误。
C. ClO- 和ClO3-中氯原子化合价分别是+1、+5价,不可能生成氯气,故C错误。
D. 据氯原子守恒n(Cl2)=1/2[n(KCl)+ n(KClO)+ n(KClO3]=0.14mol,标况下体积是3.136L,故D错误。
故答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一种具有高能量比的新型干电池示意图如图所示,石墨电极区发生的电极反应为MnO2+e-+H2O=MnO(OH)+OH-。该装置工作时,下列叙述正确的是
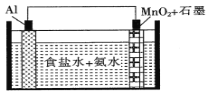
A. 石墨电极上的电势比Al电极上的低
B. Al电极区的电极反应式:A1-3e-+3NH3·H2O=Al(OH)3+3NH4+
C. 每消耗27gAl,有3mol电子通过溶液转移到石墨电极上
D. 若采用食盐水+NaOH溶液作电解质溶液,电极反应式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)是一种新兴化工原料,具有甲基化反应性能。
I.二甲醚的生产:二甲醚的生产原理之一是利用甲醇脱水成二甲醚,化学方程式如下:
反应i 2CH3OH(g) ![]() CH3OCH3(g) + H2O(g) ΔH 1
CH3OCH3(g) + H2O(g) ΔH 1
(1)已知:甲醇、二甲醚的气态标准燃烧热分别为-761.5 kJ·mol-1、-1455.2 kJ·mol-1,且H2O(g) = H2O(l) ΔH=﹣44.0 kJ·mol﹣1。则反应i的ΔH 1=_________kJ·mol﹣1.
(2)反应i中甲醇转化率、二甲醚选择性的百分率与不同催化剂的关系如下表所示,生产时,选择的最佳催化剂是_________。
催化剂 | 甲醇转化率/% | 二甲醚选择性/% |
SiO2-TiO2/SO42- | 35.1 | 98.1 |
SiO2-TiO2/Fe3+ | 52.9 | 98.7 |
GSAL-108 | 81.0 | 98.1 |
SiO2-Al2O3 | 62.1 | 96.4 |
注:反应条件:常压、温度270℃,甲醇液体空速14mL/(g·h)
(3)选定催化剂后,测得平衡时的甲醇转化率与温度的关系如图所示。经研究产物的典型色谱图发现该过程主要存在的副反应为:
反应ii 2CH3OH(g) ![]() C2H4 (g)+2H2O(g) ΔH2=﹣29.1kJ·mol﹣1
C2H4 (g)+2H2O(g) ΔH2=﹣29.1kJ·mol﹣1
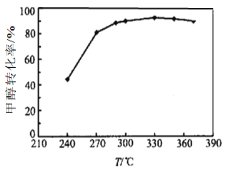
① 工业上生产二甲醚的温度通常在270-300℃,高于330℃之后,甲醇转化率下降。
根据化学平衡移动原理分析其原因可能是_________;
根据化学反应速率变化分析其原因可能是_________。
② 某温度下,以CH3OH(g)为原料,平衡时各物质的分压数据如下表:
物质 | CH3OH(g) | CH3OCH3(g) | C2H4 (g) | H2O(g) |
分压/MPa | 0.16 | 0.288 | 0.016 | … |
则反应i中,CH3OH(g)的平衡转化率α=_________。(用平衡分压代替平衡浓度计算;结果保留两位有效数字。)
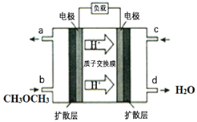
II.二甲醚的应用:
(4)下图为绿色电源“直接二甲醚燃料电池”的工作原理示意图。该电池的负极反应式为:_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:H2O2具有立体结构,两个氢原子像在一本半展开的书的两页纸上,两页纸面的夹角为94°,氧原子在书的夹缝上,O—H键与O—O键之间的夹角为97°。下列说法不正确的是( )
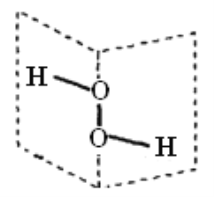
A. H2O2分子中既含极性键,又含非极性键
B. H2O2为极性分子
C. H2O2分子中的两个O原子均是sp3杂化
D. H2O2分子中既有σ键,又有π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D元素在同周期中金属性最强 |
E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置___。
(2)D的最高价氧化物的水化物,所含化学键类型:___、___。
(3)B、C、D、E简单离子半径由大到小顺序为:___(填元素符号)。
(4)用电子式表示E的氢化物的形成过程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2A(g)+3B(g)![]() 4C(g),下列各数据表示不同条件下的化学反应速率,其中反应进行得最快的是
4C(g),下列各数据表示不同条件下的化学反应速率,其中反应进行得最快的是
A.υ(C)=3.6mol/(L·min)B.υ(B)=0.04mol/(L·s)
C.υ(B)=0.9mol/(L·min)D.υ(A)=1.6mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是( )
A. 乙醇与溴化氢的水溶液共热:CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
B. 甲烷和氯气在光照条件下的反应:2CH4+Cl2![]() 2CH3Cl+H2
2CH3Cl+H2
C. 苯酚溶液中滴入NaOH溶液:H++ OH-![]() H2O
H2O
D. 苯酚钠溶液中通入少量CO2:CO2+ H2O + 2C6H5O-![]() 2C6H5OH + 2CO32—
2C6H5OH + 2CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
A. 新戊烷与2,2二甲基丙烷的结构不同
B. 2,2,3,3四甲基丁烷在核磁共振谱(![]() )上有两组峰
)上有两组峰
C. CH2=CH—CH=CH—CH3和CH3CH2C≡CCH3可能共面的碳原子数都是5
D. C6H12分子中所有碳原子不可能共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
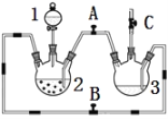
(1)稀硫酸应放在中___(填写仪器名称).
(2)本实验通过控制A、B、C三个开关将仪器中的空气排尽后,再关闭开关___、打开开关___,就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由___。
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是___。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O](相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为了洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是___
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取ag产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
Ⅰ.滴定过程中发生反应的离子方程式为___。
Ⅱ.上表中第一次实验中记录数据明显大于后两次,其原因可能是___(填字母代号)。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴无气泡,滴定结束有气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
Ⅲ.通过实验数据计算的该产品纯度为___(用字母a、c表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com