
| A. | 苯是来自于煤的基本化工原料 | |
| B. | 水煤气是通过煤的液化得到的气体燃料 | |
| C. | 甲烷水合物是由甲烷和水组成的混合物 | |
| D. | 石油裂解得到的汽油可萃取溴水中的溴 |
科目:高中化学 来源: 题型:选择题
| A. | 加入氢氧化钠固体 | B. | 加水 | ||
| C. | 通入氯化氢气体 | D. | 加入饱和石灰水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K、Na、Li | B. | Al、Mg、Na | C. | F、Cl、Br | D. | Cl、S、P |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 3
3
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断金属性强弱 | |
| B. | 在MgCl2与AlCl3溶液中分别加入过量氨水,判断Mg与Al的金属性强弱 | |
| C. | 硅酸钠溶液中通入CO2气体,判断碳与硅的非金属性强弱 | |
| D. | Br2与I2分别与足量H2反应,判断溴与碘的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
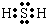 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入BaCl2溶液,有白色沉淀,则原溶液一定存在Ag+或SO42- | |
| B. | 用洁净铁丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液中有Na+ | |
| C. | 向某溶液滴加NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,可确定原溶液中无NH4+ | |
| D. | 向某溶液中加入足量的盐酸,放出二氧化碳气体,可证明该溶液中一定含有碳酸盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com