
分析 A.Na2O2+2HCl═2NaCl+H2O2,该反应中各元素的化合价没有变化,所以不是氧化还原反应;
B.Ag2O+H2O2═2Ag+O2+H2O,根据化合价的变化知,氧化剂是Ag2O,还原剂是H2O2,Ag2O的氧化性大于H2O2的氧化性,O2为氧化产物;
C.2H2O2═2H2O+O2,根据化合价的变化知,H2O2既是氧化剂又是还原剂;
D.3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O,根据化合价的变化知,H2O2是氧化剂,以此解答(1)、(2);
(3)电子守恒时两个反应相加得到氧化还原反应;
(4)Al元素的化合价由0升高为+3价,N元素的化合价由+5价降低为0,结合原子、电子守恒配平.
解答 解:(1)O元素的化合价降低,只表现氧化性,则以上反应中H2O2仅体现氧化性的反应为D,
故答案为:D;
(2)O元素的化合价升高也降低可体现氧化性、还原性,则以上反应中H2O2既体现氧化性又体现还原性的反应是C,
故答案为:C;
(3)由氧化反应:H2O2-2e-═2H++O2↑、还原反应:MnO4-+5e-+8H+═Mn2++4H2O及电子守恒可知,该氧化还原反应的化学方程式为5H2O2+2MnO4-+6H+═2Mn2++8H2O+5O2↑,故答案为:5H2O2+2MnO4-+6H+═2Mn2++8H2O+5O2↑;
(4)Al元素的化合价由0升高为+3价,N元素的化合价由+5价降低为0,由原子、电子守恒可知反应为10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O,
故答案为:10;6;4;10;3;2.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子守恒在配平中的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 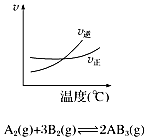 如图说明此反应的正反应是吸热反应 | |
| B. | 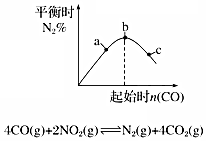 如图说明NO2的转化率b>a>c | |
| C. |  如图说明反应至15 min时,改变的条件是升高温度 | |
| D. |  如图说明生成物D一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ (CO)=0.6 mol/(L•min) | |
| B. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol | |
| C. | 4 min后,若升高温度,SO2物质的量浓度变为0.7mol/L,则正反应为放热反应 | |
| D. | 4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制100mL该溶液需用5.85g NaCl | |
| B. | 该溶液的物质的量浓度为1mol•L -1 | |
| C. | 该溶液中含有58.5g NaCl | |
| D. | 量取100mL该溶液,其中Na+的物质的量为0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 920 mL,107.64 g | B. | 500 mL,117 g | ||
| C. | 1000 mL,117.0g | D. | 任意规格,107.64 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同 | |
| B. | 中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 | |
| C. | 若①2H2(g)+O2(g)═2H2O(g)△H=-akJ•mol-1,②2H2(g)+O2(g)═2H2O(l)△H=-bkJ•mol-1,则 a>b | |
| D. | 能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com