
【题目】常温下,在10 mL0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未两出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是( )
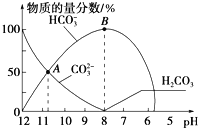
A.在0.1 mol/L Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
B.在B点所示的溶液中,浓度最大的离子是Na+
C.在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-)
D.当溶液的pH为7时,溶液的总体积为20mL
【答案】B
【解析】
A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),A错误;
B.B点溶液pH=8,溶液显呈碱性,溶质为NaCl和NaHCO3,溶液中存在电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)+c(Cl-),由于氢离子浓度较小,则离子浓度最大的为Na+,B正确;
C.根据图象分析,A点为碳酸钠和碳酸氢钠的混合溶液,且c(CO32-)=c(HCO3-),溶液呈碱性,则c(OH-)>c(H+),盐溶液水解程度较小,所以c(CO32-)>c(OH-),因此溶液中离子浓度大小顺序为:c(CO32-)+c(HCO3-)>c(OH-)>c(H+),C错误;
D.当混合溶液体积为20 mL时,二者恰好反应生成NaHCO3,HCO3-的电离程度小于其水解程度,所以其溶液呈碱性,要使混合溶液呈中性,则盐酸应该稍微过量,所以混合溶液体积稍微大于20 mL,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究二氧化硫气体的性质。

请回答:
(1)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是__。
(2)当观察到②中溶液颜色变浅时,①中的现象是__。
(3)②中的溶液颜色变浅,说明二氧化硫具有的性质是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的有
①碱性氧化物:Na2O2、MgO、A12O3
②常温下Cu、Fe、Al均不能和浓硫酸发生化学反应
③Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
④分别以熔融的NaCl、MgCl2、Al2O3为原料通过电解法制取金属Na、Mg、Al
⑤碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的均一、透明的分散系分别为:溶液、胶体
A. ①④⑤ B. ③④⑤ C. ②③④ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅是制作光伏电池的关键材料。将SiCl4氢化为SiHCl3的热化学方程式为:3SiCl4+2H2(g)+Si(s)![]() 4SiHCl3(g) △H2<0
4SiHCl3(g) △H2<0
(1)该反应是____________反应(填吸热、放热)
(2)在相同条件,相同时间t时,不同温度下该反应中SiCl4转化率如图所示。下列叙述正确的是________________(填序号)。

a.相同时间t内,A点的平均反应速率大于B点
b.相同时间t时,B点:v正>v逆
c.相同时间t时,v逆:C点大于A点
d.工业生产中采用了适宜温度:480~520°C
(3)为了增大化学反应速率,除加入催化剂、升高温度外还可以采用哪些方法和措施:___。(只写出一条)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由γ-羟基丁酸生成γ-丁内酯的反应如下:
![]()
γ-羟基丁酸水溶液的初始浓度为1.50 mol/L,在不同温度下测得γ-羟基丁酸的浓度随时间变化的数据如表所示。回答下列问题:
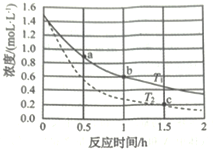
(1)温度T1________T2(大于、小于、相等、不能确定)。
(2)b点时用γ-丁内酯表示的反应速率ν(丁内酯)=_____________。
(3)c点时γ-羟基丁酸的转化率a%=__________。(保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,由醋酸和醋酸钠按一定比例混合形成的溶液始终保持c(CH3COOH) +c(CH3COO-)= 0.1mol/L,该溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如下图所示,下列有关该溶液的叙述中正确的是

A.pH=5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)=c(CH3COOH)
C.pH=3的溶液中:c(H+)+c(Na+)+c(CH3COOH)=0.1mol/L
D.据图像可求得该温度下CH3COOH的电离常数Ka=10-4.75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验.

(1)仪器连接安装完毕,进行实验前如何检验装置的气密性:_____;
(2)实验过程中铜网出现的现象________;
(3)甲和乙两个水浴作用不相同.甲的作用是__;乙的作用是__;.
(4)反应进行一段时间后,试管a中能收集到不同的物质,它们是__,集气瓶中收集到的气体的主要成分是__;
(5) 若试管a中收集到的液用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_____,要除去该物质,可先在混合液中加入______(填写字母),然后,再通过_____(填实验操作名称)即可除去。
a、氯化钠溶液 b、苯 c、碳酸氢钠溶液 d、四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1氨水中存在如下电离平衡:NH3·H2O ![]() NH4++OH-,对于该平衡,下列叙述正确的是
NH4++OH-,对于该平衡,下列叙述正确的是
A. 加入水时,溶液中c(OH-) 增大
B. 加入少量NH4Cl固体,平衡向逆方向移动,电离平衡常数减小
C. 通入少量HCl气体,溶液中c(NH4+)增大
D. 降低温度,促进NH3·H2O电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
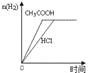


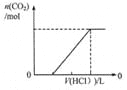
图1 图2 图3 图4
A.图1表示向等体积、等物质的量浓度的盐酸和醋酸溶液中,分别加入足量镁粉
B.图2表示向Ba(OH)2、KAlO2混合溶液中通入CO2
C.图3表示表示向盐酸和醋酸混合溶液中滴入氨水
D.图4表示在含等物质的量NaHCO3、Na2CO3的混合溶液中滴加0.1mol·L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com