
ЁОЬтФПЁПСђЫсбЧЬњОЇЬх(FeSO4ЁЄ7H2O)дквНвЉЩЯзїВЙбЊМСЁЃЮЊВтЖЈВЙбЊМСжаЬњдЊЫиЕФКЌСПЃЌФГЛЏбЇаЫШЄаЁзщЩшМЦСЫСНЬзЪЕбщЗНАИЁЃ
ЗНАИвЛ ЕЮЖЈЗЈЃКгУЫсадKMnO4ШмвКЕЮЖЈЃЌВтЖЈЬњдЊЫиЕФКЌСП
ЃЈ1ЃЉаДГіИУЕЮЖЈЗДгІЕФРызгЗНГЬЪН ЁЃ
ЃЈ2ЃЉФГЭЌбЇЩшМЦЕФЯТСаЕЮЖЈЗНЪНжаЃЌзюКЯРэЕФЪЧ________(МаГжВПЗжТдШЅ)(ЬюзжФИађКХ)
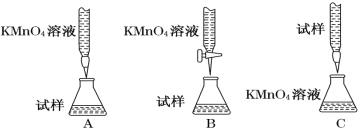
ЃЈ3ЃЉЪЕбщЧАЃЌЪзЯШвЊОЋШЗХфжЦвЛЖЈЮяжЪЕФСПХЈЖШЕФKMnO4ШмвК250 mLЃЌХфжЦЪБашвЊЕФвЧЦїГ§ЬьЦНЁЂвЉГзЁЂЩеБЁЂНКЭЗЕЮЙмЭтЃЌЛЙаш (ЬювЧЦїУћГЦ)ЁЃ
дкШмвКХфжЦЙ§ГЬжаЃЌЯТСаВйзїЛсЕМжТХфжЦНсЙћЦЋЕЭЕФЪЧ___________(ЬюаДДњКХ)ЁЃ
a. ЖЈШнЪБЃЌИЉЪгШнСПЦППЬЖШЯп
b. ШнСПЦПдкЪЙгУЧАФкгаЩйСПеєСѓЫЎ
c. зЊвЦШмвККѓЕФЩеБЁЂВЃСЇАєЮДЯДЕг
d. ЖЈШнКѓвЁдШЃЌЗЂЯжвКУцНЕЕЭЃЌгжВЙМгЩйСПЫЎЃЌжиаТДяЕНПЬЖШЯп
ЃЈ4ЃЉЩЯЪіЪЕбщжаKMnO4ШмвКашвЊЫсЛЏЃЌгУгкЫсЛЏЕФЫсЪЧ________ЁЃ
a.ХЈбЮЫс b.ЯЁСђЫс c.ЯЁЯѕЫс d.ХЈСђЫс
ЗНАИЖў ГЦСПЗЈЃКВйзїСїГЬШчЯТЃК

ЃЈ5ЃЉаДГіВНжшЂкжаH2O2бѕЛЏFe2+ ЕФРызгЗНГЬЪН______ __ЁЃ
ВНжшЂкжаГ§гУH2O2ЭтЛЙПЩвдЪЙгУЕФЮяжЪЪЧ
ВНжшЂкЪЧЗёПЩвдЪЁТд ЃЌРэгЩЪЧ ЁЃ
ЃЈ6ЃЉВНжшЂмвЛЯЕСаВйзївРДЮЪЧЃКЙ§ТЫЁЂЯДЕгЁЂ ЁЂРфШДЁЂГЦСПЁЃ
ЃЈ7ЃЉМйЩшЪЕбщЮоЫ№КФЃЌдђУПЦЌВЙбЊМСКЌЬњдЊЫиЕФжЪСП g(гУКЌaЕФДњЪ§ЪНБэЪО)ЁЃ
ЁОД№АИЁПЃЈ1ЃЉ5Fe2++MnO4Љ+8H+=5Fe3++Mn2++4H2OЃЛ
ЃЈ2ЃЉBЃЛ
ЃЈ3ЃЉ250mLШнСПЦПЁЂВЃСЇАєЃЛcd
ЃЈ4ЃЉbЃЛ
ЃЈ5ЃЉ2Fe2+ + H2O2 +2 H+ЃН2Fe3+ +2 H2OЃЛТШЫЎЃЛЗёЃЛFe2+гыМюЗДгІКѓВЛФмБЃжЄFe2+ШЋВПзЊЛЏЮЊFe3+ЃЌМгШШВЛФмЕУЕНДПОЛЕФFe2O3ЃЌЙЪЮоЗЈзМШЗМЦЫуFeЕФКЌСПЃЛ
ЃЈ6ЃЉзЦЩеЛђМгШШЃЛ
ЃЈ7ЃЉ0.07a
ЁОНтЮіЁП
ЪдЬтЗжЮіЃКЗНАИвЛЃКЃЈ1ЃЉЫсадИпУЬЫсМиОпгаЧПбѕЛЏадЃЌНЋFe2+бѕЛЏЮЊFe3+ЃЌБЛЛЙдЮЊMn2+ЃЌЭЌЪБЩњГЩЫЎЃЌЗДгІРызгЗНГЬЪНЮЊ5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2OЃЌЙЪД№АИЮЊЃК5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2OЃЛ
ЃЈ2ЃЉЫсадИпУЬЫсМиОпгаЧПбѕЛЏадЃЌПЩвдИЏЪДЯ№ЦЄЙмЃЌгІЪЂЗХдкЫсЪНЕЮЖЈЙмФкЃЌСђЫсбЧЬњШмвКГЪЫсадЃЌгІЪЂЗХдкЫсЪНЕЮЖЈЙмФкЃЌЙЪBзюКЯЪЪЃЌЙЪД№АИЮЊЃКBЃЛ
ЃЈ3ЃЉОЋШЗХфжЦвЛЖЈЮяжЪЕФСПХЈЖШЕФKMnO4ШмвК250mLЃЌХфжЦЪБашвЊЕФвЧЦїгаЬьЦНЁЂвЉГзЁЂВЃАєЁЂЩеБЁЂНКЭЗЕЮЙмЁЂ250mLШнСПЦПЃЛa. ЖЈШнЪБЃЌИЉЪгШнСПЦППЬЖШЯпЃЌЕМжТШмвКЕФЬхЛ§ЦЋаЁЃЌХЈЖШЦЋДѓЃЌДэЮѓЃЛb. ШнСПЦПдкЪЙгУЧАФкгаЩйСПеєСѓЫЎЃЌЖдЪЕбщНсЙћЮогАЯьЃЌДэЮѓЃЛc. зЊвЦШмвККѓЕФЩеБЁЂВЃСЇАєЮДЯДЕгЃЌЕМжТШмжЪЕФЮяжЪЕФСПЦЋаЁЃЌХЈЖШЦЋЕЭЃЌе§ШЗЃЛd. ЖЈШнКѓвЁдШЃЌЗЂЯжвКУцНЕЕЭЃЌгжВЙМгЩйСПЫЎЃЌжиаТДяЕНПЬЖШЯпЃЌЕМжТЕМжТШмвКЕФЬхЛ§ЦЋДѓЃЌХЈЖШЦЋаЁЃЌе§ШЗЃЛЙЪбЁcdЃЛЙЪД№АИЮЊЃК250mLШнСПЦПЁЂВЃСЇАєЃЛcdЃЛ
ЃЈ4ЃЉЫсЛЏKMnO4ШмвКЕФЫсБОЩэВЛФмОпгаЛЙдадЃЌШчЙћгаЛЙдадвЊБЛИпУЬЫсМибѕЛЏЃЌБОЩэвВВЛФмОпгаЧПбѕЛЏадЃЌЫљвджЛФмбЁСђЫсЃЌЙЪД№АИЮЊЃКbЃЛ
ЗНАИЖўЃКЃЈ5ЃЉВНжшЂкМгШыгаЧПбѕЛЏадЪдМСЃЌФмНЋFe2+ШЋВПбѕЛЏЮЊFe3+ЃЌЗДгІЕФРызгЗНГЬЪНЮЊ2Fe2+ + H2O2 +2 H+ЃН2Fe3+ +2 H2OЃЌГ§гУH2O2ЭтЛЙПЩвдЪЙгУТШЫЎЕШЃЛFe2+гыМюЗДгІКѓВЛФмБЃжЄFe2+ШЋВПзЊЛЏЮЊFe3+ЃЌМгШШВЛФмЕУЕНДПОЛЕФFe2O3ЃЌЙЪЮоЗЈзМШЗМЦЫуFeЕФКЌСПЃЌЙЪВНжшЂкВЛФмЪЁТдЃЌЙЪД№АИЮЊЃК2Fe2+ + H2O2 +2 H+ЃН2Fe3+ +2 H2OЃЛТШЫЎЃЛЗёЃЛFe2+гыМюЗДгІКѓВЛФмБЃжЄFe2+ШЋВПзЊЛЏЮЊFe3+ЃЌМгШШВЛФмЕУЕНДПОЛЕФFe2O3ЃЌЙЪЮоЗЈзМШЗМЦЫуFeЕФКЌСПЃЛ
ЃЈ6ЃЉВНжшЂмжавЛЯЕСаДІРэЪЧгЩЧтбѕЛЏЬњаќзЧвКзюжезЊЛЏЮЊбѕЛЏЬњЃЌашвЊЙ§ТЫЁЂЯДЕгЕФЧтбѕЛЏЬњЃЌШЛКѓзЦЩеЩњГЩбѕЛЏЬњЃЌРфШДКѓГЦСПбѕЛЏЬњЕФжЪСПЃЛЙЪД№АИЮЊЃКзЦЩеЃЛ
ЃЈ7ЃЉagбѕЛЏЬњжаЬњдЊЫиЕФжЪСПМДЮЊ10ЦЌВЙбЊМСжаЬњЕФжЪСПЃЌЫљвдУПЦЌВЙбЊМСКЌЬњдЊЫиЕФжЪСП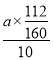 =0.07agЃЌЙЪД№АИЮЊЃК0.07aЁЃ
=0.07agЃЌЙЪД№АИЮЊЃК0.07aЁЃ


 дФЖСПьГЕЯЕСаД№АИ
дФЖСПьГЕЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМКжЊAЁЂBЁЂCЪЧШ§жжГЃМћЕФЙЬЬхЛЏКЯЮяЁЃбцЩЋЗДгІОљЯдЛЦЩЋЁЃЦфжаAгыCАДШЮвтБШР§ЛьКЯЃЌШмгкзуСПЕФЫЎжаЃЌЕУЕНЕФШмжЪжЛКЌгавЛжжЃЌВЂгаЮоЩЋЮоЮЖЕФЦјЬхDЗХГіЁЃСэAЁЂBЁЂCЁЂDжЎМфгаШчЭМЫљЪОЕФзЊЛЏЙиЯЕ(ВПЗжЮяжЪЮДаДГі)ЃК
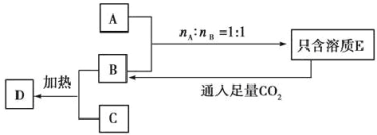
ЃЈ1ЃЉаДГіЯТСаЮяжЪЕФЛЏбЇЪНЃК
A________ЁЂB________ЁЂC________ЁЃ
ЃЈ2ЃЉаДГіAЁЂBАДЮяжЪЕФСПжЎБШ1ЃК1дкУмБеШнЦїжаМгШШЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЃК______________________ЁЃ
ЃЈ3ЃЉаДГіБЅКЭЕФEШмвКгызуСПCO2ЗДгІЕФРызгЗНГЬЪНЃК________ЁЃ
ЃЈ4ЃЉгаЙиТСЁЂЬњЁЂЭЕФЫЕЗЈе§ШЗЕФЪЧ________ (ЬюДњКХ)ЁЃ
aЃЎТСЪєгкжїзхдЊЫиЃЌЬњКЭЭЪєгкЙ§ЖЩдЊЫи
bЃЎЙЄвЕЩЯРћгУЕчНтЗЈвБСЖТСЁЂЬњЁЂЭ
cЃЎТСЁЂЬњЁЂЭЖдгІЕФбѕЛЏЮяОљЮЊМюадбѕЛЏЮя
dЃЎТСЁЂЬњЁЂЭГЃЮТЯТЖМВЛШмгкХЈСђЫс
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮвЙњЛЏЙЄзЈМвКђЕТАёЕФЁАКђЪЯжЦМюЗЈЁБдјЮЊЪРНчжЦМюЙЄвЕзїГіСЫЭЛГіЙБЯзЁЃЫћвд NaClЁЂNH3ЁЂCO2ЕШЮЊдСЯЯШжЦЕУ NaHCO3,НјааЩњВњГіДПМюЁЃгаЙиЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃКNH3+CO2+H2O=NH4HCO3ЃЛNH4HCO3+NaCl=NaHCO3Ё§+NH4Cl;2NaHCO3![]() Na2CO3+CO2Ёќ+H2O
Na2CO3+CO2Ёќ+H2O
ЃЈ1ЃЉЬМЫсЧтяЇгыБЅКЭЪГбЮЫЎЗДгІЃЌФмЮіГіЬМЫсЧтФЦОЇЬхЕФдвђЪЧ__________________ЃЈЬюзжФИБъКХЃЉЁЃ
a.ЬМЫсЧтФЦФбШмгкЫЎ
b.ЬМЫсЧтФЦЪмШШвзЗжНт
c.ЬМЫсЧтФЦЕФШмНтЖШЯрЖдНЯаЁЃЌЫљвддкШмвКжаЪзЯШНсОЇЮіГі
ЃЈ2ЃЉФГЬНОПЛюЖЏаЁзщИљОнЩЯЪіжЦМюдРэЃЌНјааЬМЫсЧтФЦЕФжЦБИЪЕбщЃЌЭЌбЇУЧАДИїздЩшМЦЕФЗНАИЪЕбщЁЃ
ЂйвЛЮЛЭЌбЇНЋЖўбѕЛЏЬМЦјЬхЭЈШыКЌАБЕФБЅКЭЪГбЮЫЎжажЦБИЬМЫсЧтФЦЃЌЪЕбщзАжУШчЯТЭМЫљЪОЃЈЭМжаМаГжЁЂЙЬЖЈгУЕФвЧЦїЮДЛГіЃЉЃК
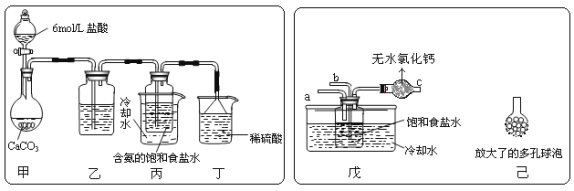
ЪдЛиД№ЯТСа гаЙиЮЪЬтЃК
ЃЈЂёЃЉввзАжУжаЕФЪдМСЪЧ__________________ЃЛ
ЃЈЂђЃЉЖЁзАжУжаЯЁСђЫсЕФзїгУЪЧ__________________ЃЛ
ЂкСэвЛЮЛЭЌбЇгУЭМжаЮьзАжУЃЈЦфЫћзАжУЮДЛГіЃЉНјааЪЕбщЁЃ
ЃЈЂёЃЉЪЕбщЪБЃЌаыЯШДгaЙмЭЈШы__________ЦјЬхЃЌдйДгbЙмжаЭЈШы__________ЦјЬхЃЛ
ЃЈЂђЃЉгаЭЌбЇНЈвщдкЮьзАжУЕФbЙмЯТЖЫСЌНгвбзАжУЃЌРэгЩЪЧ__________________ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП400mLФГШмвКжаКЌга0.1mol Fe2+ЁЂ0.2mol Fe3+МгШы0.2molЬњЗл,Д§Fe3+ЗДгІЭъШЋКѓ,ШмвКжаFe2+ЕФЮяжЪЕФСПХЈЖШЮЊ(МйЩшЗДгІЧАКѓШмвКЬхЛ§ВЛБф)ЃЈ ЃЉ
A.0.4molЁЄL-1 B.0.6molЁЄL-1 C.0.8molЁЄL-1 D.1.0molЁЄL-1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкЪвЮТЪБЃЌЭЌжжЙцИёЕФТСЦЌЗжБ№гыЯТСаЮяжЪЛьКЯЃЌЗДгІПЊЪМЪБЩњГЩЧтЦјЫйТЪзюДѓЕФЪЧ
AЃЎ0.1mol/LбЮЫс15ml
BЃЎ0.15mol/LСђЫс8ml
CЃЎ0.2mol/LбЮЫс12ml
DЃЎ18mol/LСђЫс15ml
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮвЙњПеЦјжЪСПдЄБЈЕФФкШнжївЊАќРЈШ§ИіЗНУцЃКЖўбѕЛЏСђЁЂЕЊбѕЛЏЮя(NOx)ЁЂаќИЁПХСЃЮяЕШШ§жжДѓЦјЮлШОЮяЕФХЈЖШЁЃ
ЃЈ1ЃЉЂйгыЕЊбѕЛЏЮягаЙиЕФШЋЧђЛђЧјгђадДѓЦјЛЗОГЮЪЬтга______________(ЬюзжФИађКХ)ЁЃ
aЃЎЫсгъ bЃЎЩГГОБЉ cЃЎЙтЛЏбЇбЬЮэ d. ЮТЪваЇгІ
ЂкаќИЁПХСЃЮяПЩгУИпбЙЕчГ§ГОЃЌЪЧРћгУСЫ ЯжЯѓ
ЃЈ2ЃЉЮЊСЫНЕЕЭЦћГЕЮВЦјЖдДѓЦјЕФЮлШОЃЌФПЧАзюгааЇЕФЗНЗЈЪЧИјЦћГЕАВзАЮВЦјОЛЛЏзАжУЁЃЫќФмНЋЮВЦјжаЕФвЛбѕЛЏЬМКЭNOдкДпЛЏМСзїгУЯТЃЌЗЂЩњЗДгІзЊЛЏЮЊЮоКІЦјЬхЃЌЦфЗДгІЕФЛЏбЇЗНГЬЪНЮЊ ЁЃ
ЃЈ3ЃЉЂйаДГіЪЕбщЪвжагЩЙЬЬхЮяжЪжЦШЁАБЦјЕФЛЏбЇЗНГЬЪН ЃЛ
ЂкгћЪеМЏвЛЦПИЩдяЕФАБЦјЃЌбЁдёЯТЭМжаЕФзАжУЃЌЦфСЌНгЫГађЮЊЃКЗЂЩњзАжУЁњ (АДЦјСїЗНЯђЃЌгУаЁаДзжФИБэЪО)

ЂлЪЕбщЪввВПЩгУЯТЭМЫљЪОзАжУжЦШЁАБЦјЁЃЩеЦПФкЙЬЬхПЩбЁгУ____________(бЁЬюбЁЯюЕФДњКХ)ЁЃ
aЃЎМюЪЏЛв bЃЎЩњЪЏЛв cЃЎЖўбѕЛЏЙш dЃЎЮхбѕЛЏЖўСз

ЂмДпЛЏМСДцдкЯТЃЌNH3вВПЩгУРДЯћГ§NOxЕФЮлШОЃЌЩњГЩСНжжЖдЛЗОГЮоКІЕФЮяжЪЃЌЧыаДГіNH3гыNO2ЗДгІЕФЛЏбЇЗНГЬЪНЮЊ ЃЌИУЗДгІжаУПЩњГЩ0.5molN2зЊвЦ molЕчзгЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉдЊЫижмЦкБэЗжЮЊ ИіКсааЃЌМД ИіжмЦкЃЌжмЦкБэжага ИізнааЃЌЙВ ИізхЁЃЃЈУППе1ЗжЃЉ
ЃЈ2ЃЉаДГіЯТСаЮяжЪЕФЕчзгЪНЃКЂйCO2 ЃЛЂкNaOH ЁЃЃЈУППе2ЗжЃЉ
ЃЈ3ЃЉЯТБэЪЧдЊЫижмЦкБэЕФвЛВПЗжЃЌеыЖдБэжаЕФЂйЁЋЂтжадЊЫиЃЌгУдЊЫиЗћКХЛђЛЏбЇЪНЬюПеЛиД№вдЯТЮЪЬтЃКЃЈРызгЗНГЬЪН2ЗжЃЌЦфгрУППе1ЗжЃЉ
жїзх | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
Жў | Ђй | Ђк | ||||||
Ш§ | Ђл | Ђм | Ђн | Ђо | Ђп | Ђр | ||
ЫФ | Ђс | Ђт |
Ђй дкетаЉдЊЫижазюЛюЦУЕФЗЧН№ЪєдЊЫиЪЧ ЁЃ
Ђк дЊЫиЕФзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяжаЫсадзюЧПЕФЪЧ ЃЌМюадзюЧПЕФЪЧ ЁЃ
Ђл ГЪСНадЕФЧтбѕЛЏЮяЪЧ ЃЌЦфгыЂлЕФзюИпМлбѕЛЏЮяЫЎЛЏЮяЗДгІЕФРызгЗНГЬЪНЮЊ ЁЃ
Ђм дкЂлЁЋЂпдЊЫижаЃЌдзгАыОЖзюДѓЕФЪЧ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЪЕбщаЁзщгУЯТЭМзАжУжЦБИМвгУЯћЖОвКЃЌВЂЬНОПЦфаджЪЁЃ
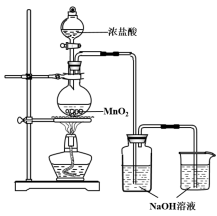
ЗДгІЭЃжЙКѓЃЌШЁЯДЦјЦПжаЮоЩЋШмвК5mLЗжБ№НјааСЫШчЯТЪЕбщЃК
Вйзї | ЯжЯѓ |
a. ВтШмвКpH, ВЂЯђЦфжаЕЮМг2ЕЮЗгЬЊ | pH = 13, ШмвКБфКьЃЌ5minКѓЭЪЩЋ |
b. ЯђЦфжаж№ЕЮМгШыбЮЫс | ШмвКж№НЅБфГЩЛЦТЬЩЋ |
ЃЈ1ЃЉаДГіРћгУЩЯЪізАжУжЦБИЯћЖОвКЩцМАЗДгІЕФЛЏбЇЗНГЬЪН ЁЂ ЁЃ
ЃЈ2ЃЉВщдФзЪСЯЃКЗгЬЊЕФБфЩЋЗЖЮЇЮЊ8.2ЁЋ10ЃЌЧвЗгЬЊдкЧПМюадШмвКжаКьЩЋЛсЭЪШЅ
ЮЊЬНОПВйзїaжаШмвКЭЪЩЋЕФдвђЃЌгжВЙГфСЫШчЯТЪЕбщЃК
Вйзї | ЯжЯѓ |
ШЁ NaOHШмвКЃЌЯђЦфжаЕЮМг2ЕЮЗгЬЊ | ШмвКБфКьЃЌ30minКѓЭЪЩЋ |
ЛёЕУНсТлЃКДЫЪЕбщаЁзщжЦБИЕФЯћЖОвКОпга адЁЃ
ЃЈ3ЃЉ ИУаЁзщгЩВйзїbЛёЕУНсТлЃКЫцзХШмвКЫсадЕФдіЧПЃЌДЫЯћЖОвКЕФЮШЖЈадЯТНЕЁЃ
Ђй ВйзїbжаШмвКБфГЩЛЦТЬЩЋЕФдвђЃК (гУРызгЗНГЬЪНБэЪО)ЁЃ
Ђк гаЭЌбЇШЯЮЊгЩВйзїbЛёЕУЩЯЪіНсТлВЂВЛбЯНїЃЌашвЊНјвЛВНШЗШЯДЫНсТлЕФЪЕбщЗНАИЪЧ ЁЃ
ЃЈ4ЃЉ гааЇТШЕФКЌСПЪЧМьВтКЌТШЯћЖОМСЯћЖОаЇЙћЕФживЊжИБъЁЃОпЬхгУЁАЕЅЮЛжЪСПЕФКЌТШЯћЖОвКдкЫсадЬѕМўЯТЫљФмЪЭЗХГіТШЦјЕФжЪСПЁБНјааБэеїЃЌвЛАуМвгУЯћЖОвКгааЇТШКЌСПдк5%вдЩЯЁЃаЁзщЭЌбЇНјааШчЯТЪЕбщВтЖЈгааЇТШЃКШЁДЫЯћЖОвК5 gЃЌМгШы20 mL 0.5 molЁЄL-1 KIШмвКЃЌ10 mL 2 molЁЄL-1ЕФСђЫсШмвКЃЛМгМИЕЮЕэЗлШмвККѓЃЌгУ0.1 molЁЄL-1 Na2S2O3ШмвКЕЮЖЈЩњГЩЕФI2ЃЌДяЕЮЖЈжеЕуЪБЯћКФNa2S2O3 20 mLЁЃ(вбжЊЃК2S2O32- + I2 === S4O62- + 2I-) ЁЃзЂЃКЯрЖддзгжЪСПCl35.5ЃЌNa23ЃЌS32ЃЌO 16 ЃЌI 127ЃЌ K39
ЂйДяЕНЕЮЖЈжеЕуЪБЕФЪЕбщЯжЯѓЪЧ ЁЃ
ЂкДЫЯћЖОвКгааЇТШКЌСПЮЊ %(БЃСєвЛЮЛгааЇЪ§зж)ЁЃЛёЕУНсТлЃКДЫЪЕбщжЦЕУЕФЯћЖОвК ЃЈЬюЁАЗћКЯЁБЛђЁАВЛЗћКЯЁБЃЉМвгУвЊЧѓЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПIЃЎввЯЉЪЧЪЏгЭСбНтЦјЕФжївЊГЩЗжЃЌЯТЭМЪЧЪЏРЏгЭдкГуШШЫщДЩЦЌЕФзїгУЯТСбНтЃЌЯТСазАжУМьбщЦфаджЪЃЌЭъГЩЯТСаЮЪЬтЁЃ

ЃЈ1ЃЉAжаЫщДЩЦЌЕФзїгУЪЧ_____________ЁЃ
ЃЈ2ЃЉBжаЗДгІРраЭЪЧ_____________ЃЌCжаЪЕбщЯжЯѓЪЧ__________________ЁЃ
II.гУШчЭМЫљЪОЕФзАжУНјааЪЕбщЃЌЛиД№ЯТСаЮЪЬтЃК
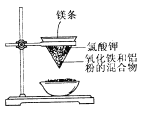
ЃЈ1ЃЉаДГіИУЗДгІЕФЛЏбЇЗНГЬЪНЃК_____________________ЁЃ
ЃЈ2ЃЉбЁГіИУЪЕбщЕФЪЕбщЯжЯѓЃЈАбађКХЬюаДдкКсЯпЩЯЃЉЃК________________ЁЃ
ЂйУОЬѕОчСвШМЩеЃЛЂкЗХГіДѓСПЕФШШЃЌВЂЗЂГівЋблЕФЙтУЂЃЛЂлжНТЉЖЗЕФЯТВПБЛЩеДЉЃЛЂмгаКьШШзДЬЌЕФвКжщТфШыеєЗЂУѓФкЕФЯИЩГЩЯЃЌвКжщРфШДКѓБфЮЊКкЩЋЙЬЬхЁЃ
ЃЈ3ЃЉаДГіЯТСаВйзїЛђЮяжЪЕФзїгУЃКУОЬѕ________ЃЛТШЫсМи_________ЃЛеєЗЂУѓЪЂЩГ____________ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com