
在100mL某浓度的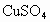 溶液中,加入一质为45.0g的铁棒.反应一段时间后,取出洗净,干燥后称量,称得质量变为46.6g,求:
溶液中,加入一质为45.0g的铁棒.反应一段时间后,取出洗净,干燥后称量,称得质量变为46.6g,求:
(1)反应掉的铁的质量为多少克?
(2)若反应后溶液体积不变,所得溶液中的物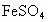 物质的量浓度.
物质的量浓度.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 (2011?崇明县一模)在500mL 某浓度的硝酸溶液中加入20g铁粉,充分反应后,将反应液过滤、洗涤、干燥,称得固体质量为3.2g,产生的NO2和NO气体经测定为8.96L(标准状况).
(2011?崇明县一模)在500mL 某浓度的硝酸溶液中加入20g铁粉,充分反应后,将反应液过滤、洗涤、干燥,称得固体质量为3.2g,产生的NO2和NO气体经测定为8.96L(标准状况).| 40n |
| 3 |
| 40n |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?长宁区一模)Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.
(2012?长宁区一模)Ⅰ将a mol的Na2O2和bmol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,假设NaHCO3分解产生的CO2与Na2O2反应完后,H2O再与Na2O2反应.| a |
| 2 |
| a |
| 2 |
| a |
| b |
| a |
| b |
| 1 |
| 2 |
| a |
| b |
| 1 |
| 2 |
| a |
| b |
| a |
| b |
| 2 |
| 3 |
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:058
在100mL某浓度的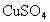 溶液中,加入一质为45.0g的铁棒.反应一段时间后,取出洗净,干燥后称量,称得质量变为46.6g,求:
溶液中,加入一质为45.0g的铁棒.反应一段时间后,取出洗净,干燥后称量,称得质量变为46.6g,求:
(1)反应掉的铁的质量为多少克?
(2)若反应后溶液体积不变,所得溶液中的物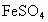 物质的量浓度.
物质的量浓度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com