
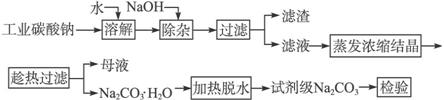
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
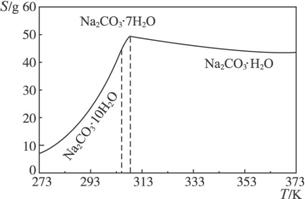
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
(1)滤渣的主要成分为________________。
(2)“趁热过滤”的原因是________________________________________。
(3)若在实验室进行“趁热过滤”,可采取的措施是_______________________(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是_____________________________。
(5)已知:Na2CO3·10H2O(s) Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s) Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式______________________________。
【答案】,化学实验方案的设计及要求—性质、制备和检验
(1)Mg(OH)2、Fe(OH)3、CaCO3
(2)使析出的晶体为Na2CO3·H2O,防止因温度过低而析出Na2CO3·10H2O晶体,令后续的加热 脱水耗时长
脱水耗时长
(3)用已预热的布氏漏斗趁热抽滤
(4)问题:溶解时有大量沉淀生成,使Na2CO3损耗且产物Na2CO3混有杂质;原因:“母液”中,含有的离子有Ca2+、Na+、Cl-、 、OH-,
、OH-, ,当多次循环后,使离子浓度不断增大,溶解时会生成CaSO4、Ca(OH)2、CaCO3等沉淀
,当多次循环后,使离子浓度不断增大,溶解时会生成CaSO4、Ca(OH)2、CaCO3等沉淀
(5)Na2CO3·H2O(s) Na2CO3(s)+H2O(g);ΔH=+58.73 kJ·mol-1
Na2CO3(s)+H2O(g);ΔH=+58.73 kJ·mol-1
【解析】(1)因工业碳酸钠中含有Mg2+、Fe3+、Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、CaCO3沉淀。
(2)观察坐标图,温度减少至308  K时发生突变,溶解度迅速减少,若不趁热过滤将析出晶体Na2CO3·7H2O。
K时发生突变,溶解度迅速减少,若不趁热过滤将析出晶体Na2CO3·7H2O。
(3)思路方向:①减少过滤的时间;②保持过滤时的温度。
(4)思路:分析“母液”中存在的离子,若参与循环,将使离子浓度增大,对工业生产中所得产品的质量有所影响。
(5)通过观察两个热化学方程式,可将两式相减,从而得到Na2CO3·H2O(s) Na2CO3(s)+H2O(g)。
Na2CO3(s)+H2O(g)。


科目:高中化学 来源: 题型:
下列叙述正确的是
A.48gO3气体含有6.02×1023个O3分子
B.5.6g Fe与足量的稀盐酸反应转移电子0.3 mol
C.0.5mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,33.6LH2O含有9.03×102 3个H2O分子
3个H2O分子
查看答案和解析>>
科目:高中化学 来源: 题型:
工业制硫酸生产流程如下图:

已知:在450℃,常压下,2SO2(g)+O2(g) 2SO3(g),ΔH=-196 kJ·mol-1。请回答:
2SO3(g),ΔH=-196 kJ·mol-1。请回答:
(1)在催化反应室,下列措施中有利于提高SO2平衡转化率的有
A.升高温度 B.减少压强 C.不断补充空气 D.及时分离出SO3
(2)在生产中,为提高催化剂效率可采取的措施为
A.净化气体  B.控制温度在400~500℃
B.控制温度在400~500℃
C.增大催化剂与反应气体的接触面积 D.不断补充空气
(3)在450℃、常压和钒催化条件下向一密闭容器中充入2molSO2和1molO2,充分反应后,放出的热量______(填“<”、“>”或“=”)196kJ。
(4)经检测生产硫酸的原料气成分(体积分数)为SO27%、O211%、N282%。在500℃,0.1MPa条件下,现有100L原料气参加反应,达到平衡时,气体的总体积变 为97.2L,则SO2的转化率为
为97.2L,则SO2的转化率为
查看答案和解析>>
科目:高中化学 来源: 题型:
磷单质及其化合物有广泛应用。
(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反应中,副产物矿渣可用来___________________________________。
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)====6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)====P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)====CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=_____________________________。
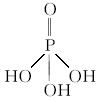
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见下图)之间脱去两个水分子的产物,其结构式为________________________。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为___________________________。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为________________________。
②化学镀镍的溶液中含有Ni2+和 ,在酸性等条件下发生下述反应:
,在酸性等条件下发生下述反应:
(a)__________Ni2++______ ____
____ +__________
+__________ __________Ni+________
__________Ni+________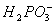 +_______
+_______
(b)6 +2H+====2P+4
+2H+====2P+4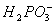 +3H2↑
+3H2↑
请在答题卡上写出并配平反应式(a)。
③利 用②中反应可在塑料镀件表面沉积镍磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
用②中反应可在塑料镀件表面沉积镍磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点:_______________;原理上的相同点:_______________;化学镀的优点:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。

根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程 式是
式是
;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2 α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是________________________
(4)P和Cl2分两步反应生成1mol PCl5的△H3=____________,P和Cl2一步反应生成1molPCl5的△H4__________△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
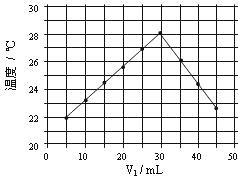
A 做该实验时环境温度为22℃
B 该实验表明化学能可能转化为热能
C NaOH溶液的浓度约为1.0mol/L
D 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的性质与氢键无关的是( )
A.冰的密度比液态水的密度小 B.NH3易液化
C.NH3 分子比PH3 分子稳定 D.在相同条件下,H2O的沸点比H2S的沸点高
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子反应方程式为( )
A.惰性电极电解MgCl2溶液:2Cl- +2 H2O 2OH- +Cl2↑ +H2↑
2OH- +Cl2↑ +H2↑
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
C.HS-的电离:
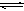

D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com