
【题目】碳、氮及其化合物与生活密切相关。请根据要求回答下列问题:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H=-l160kJ/mol
③H2O(g)= H2O(l) △H=-44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O( 1) 的热化学方程式_________。
(2)已知: 反应I: 4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H < 0
4NO(g)+6H2O(g) △H < 0
反应II: 4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) △H < 0
2N2(g)+6H2O(g) △H < 0
①在恒温恒容装置中充入一定量的NH3 和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是___(填字母序号)。
A.增大压强,Kp(用压强表示的化学平衡常数) 增大
B.若测得容器内3v正(NH3)=2v逆(H2O) 时,说明反应已达平衡
C.升高温度,NH3 的转化率增大
D.达到平衡时体系的压强不再变化
②氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2,得有关物质的量关系如图,该催化剂在高温时选择反应_____(填“I”或“II”)。
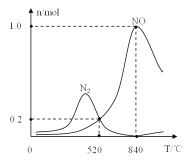
③520℃时,4NH3(g)+3O2 (g)![]() 2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。提高NH3转化为N2平衡转化率的措施有______( 填字母序号)
2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式)。提高NH3转化为N2平衡转化率的措施有______( 填字母序号)
A.降低反应温度 B.将反应生成的H2O(g)及时移出
C.增大NH3和O2的初始投料比 D.投料比不变,增加反应物的浓度
(3)己知25℃时HCN 和H2CO3的电离常数(Ka.)如下表:
物质 | 电离常数(Ka) |
HCN | Ka=5×10-10 |
H2CO3 | Ka1=4.5×10-7;Ka2=4.7× 10-11 |
25℃时,测得HCN 和NaCN 的混合溶液pH=11,则c(HCN)/c(CN-)=____。向NaCN 溶液中通入少量CO2,则发生反应的离子方程式为:__________。
【答案】 CH4(g)+2NO2(g) === N2(g)+CO2(g)+2H2O(l) △H= -955 kJ/mol BD I ![]() AB 0.02(或 1/50 ) CN-+ CO2+ H2O ===HCN+ HCO 3
AB 0.02(或 1/50 ) CN-+ CO2+ H2O ===HCN+ HCO 3
【解析】(1)根据盖斯定律,(①+②+③×4)÷2得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol。
(2)①A项,化学平衡常数只受温度影响,与压强改变无关,故A错误;B项,同一反应用不同物质表示的速率数值之比等于化学计量数之比,结合化学方程式可得:3v正(NH3)=2v正(H2O),所以3v正(NH3)=2v逆(H2O)时,v正(H2O)=v逆(H2O),说明反应已达平衡,故B正确;C项,该反应正向放热,升高温度,NH3的转化率降低,故C错误;D项,该反应正向气体分子数增大,在恒温恒容时,只要没有达到平衡压强就会改变,达到平衡时体系的压强就不再变化,故D正确。②由图可知,该催化剂在高温时,生成NO的物质的量远大于氮气的物质的量,故该催化剂在高温下选择反应I。③在1L密闭容器中充入1molNH3和2molO2,由图可得,520℃平衡时n(NO)=n(N2)=0.2mol,结合化学方程式列数据如下:

所以平衡时,n(NH3)=1mol-0.2mol-0.4mol=0.4mol,n(O2)=2mol-0.25mol-0.3mol=1.45mol,n(H2O)=0.3mol+0.6mol=0.9mol,又因为1L密闭容器,所以520℃时,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)的平衡常数K=
2N2(g)+6H2O(g)的平衡常数K=![]() (只需列出数字计算式)。A项,该反应正向放热,降低反应温度,促进平衡正向移动,能提高NH3转化为N2平衡转化率,故A正确;B项,将反应生成的H2O(g)及时移出,降低了生成物浓度,化学平衡正向移动,能提高NH3转化为N2平衡转化率,故B正确;C项,增大NH3和O2的初始投料比,提高O2的转化率,根据化学平衡移动原理,NH3的转化率会降低,故C错误;D项,该反应正向气体分子数增大,投料比不变,增加反应物的浓度,则相当于在与原平衡等效的基础上增大压强,平衡逆向移动,达到的新平衡NH3的转化率会降低,故D错误。
(只需列出数字计算式)。A项,该反应正向放热,降低反应温度,促进平衡正向移动,能提高NH3转化为N2平衡转化率,故A正确;B项,将反应生成的H2O(g)及时移出,降低了生成物浓度,化学平衡正向移动,能提高NH3转化为N2平衡转化率,故B正确;C项,增大NH3和O2的初始投料比,提高O2的转化率,根据化学平衡移动原理,NH3的转化率会降低,故C错误;D项,该反应正向气体分子数增大,投料比不变,增加反应物的浓度,则相当于在与原平衡等效的基础上增大压强,平衡逆向移动,达到的新平衡NH3的转化率会降低,故D错误。
(3)25℃时,pH=11的溶液中c(H+)=1×10-11mol/L,HCN的电离平衡常数为:Ka=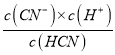 =5×10-10,则
=5×10-10,则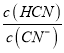 =
=![]() =0.02(或1/50);根据HCN和H2CO3的电离常数可知,酸性:H2CO3>HCN>HCO3-,则向NaCN溶液中通入少量CO2,发生反应的离子方程式为:CN-+CO2+H2O=HCN+HCO。
=0.02(或1/50);根据HCN和H2CO3的电离常数可知,酸性:H2CO3>HCN>HCO3-,则向NaCN溶液中通入少量CO2,发生反应的离子方程式为:CN-+CO2+H2O=HCN+HCO。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】可以将反应E+B2+=E2++B设计成原电池,下列4个电极反应: ①B﹣2e﹣=B2+
②E﹣2e﹣=E2+
③B2++2e﹣=B
④E2++2e﹣=E
其中表示负极反应和正极反应的分别是( )
A.②和③
B.②和①
C.③和①
D.④和①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淡黄色固体A和气体X存在如下转化关系:
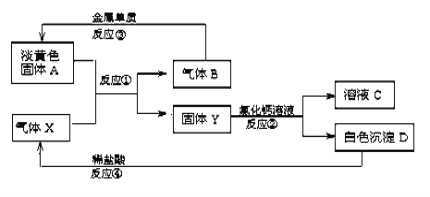
请回答下列问题:
(1)固体A的名称____________,X的化学式 ____________。
(2)反应③的化学方程式为____________________。
(3)写出反应②的离子方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能,乙图是一种用惰性电极电解饱和食盐水的消毒液发生器。关于甲、乙的说法正确的是
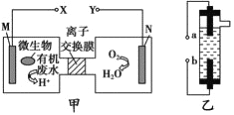
A. 装置乙中的b极要与装置甲的X极连接
B. 装置乙中a极的电极反应式为:2Cl- -2e-=Cl2↑
C. 当N极消耗5.6L(标准状况下)气体时,则有2NA个H+通过离子交换膜
D. 若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极反应为: C6H12O6+6H2O-24e-=6CO2↑+24H+
查看答案和解析>>
科目:高中化学 来源: 题型:
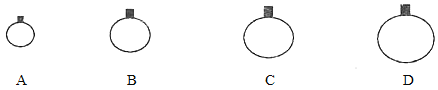
【题目】计算
(1)常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为SO2的是_____(填选项序号)。
(2)在标准状况下,2.24L由N2、N2O组成的混合气体中含有的氮元素的质量约为_______。
(3)在0.1L由KCl、K2SO4、ZnSO4形成的某植物营养液中,c(K+)=0.7 mol·L1,c(Zn2+)=0.1 mol·L1,c(Cl)=0.3mol·L1,向混合溶液中滴加足量的BaCl2溶液后产生沉淀的物质的量为_______。
(4)氯气(Cl2)、重铬酸钾(K2Cr2O7)是常用的氧化剂。
①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯气对鱼的危害。已知25.0mL0.100 mol·L1 Na2S2O3溶液恰好把标准状况下224mL的Cl2完全转化为Cl,则S2O32将转化成______。
A.S2 B.S C.SO32 D.SO42
②实验室可用K2Cr2O7固体与浓盐酸反应制备氯气,发生反应的化学方程式为K2Cr2O7 + 14HCl(浓)=3Cl2↑ + 2CrCl3 +2KCl +7H2O,若反应中转移0.6mole,则被氧化的HCl的物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种元素位于周期表中同一周期,其最高价氧化物分别为酸性氧化物、碱性氧化物、两性氧化物,则这三种元素原子序数的大小顺序是( )
A.X>Y>Z
B.X>Z>Y
C.Y>X>Z
D.Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究卤代烃与NaOH乙醇溶液反应的情况(已知乙醇可使酸性KMnO4溶液褪色),某化学课外小组的学生进行如下实验;
(1)甲同学用图1所示装置研究CH3CH2Br与NaOH的乙醇溶液的反应,充分反应后,试管D中的现象是_________________,试管C中水的作用是_______________,实验中________(填“能”或“不 能”)用Br2的四氯化碳溶液代替酸性高锰酸钾溶液。
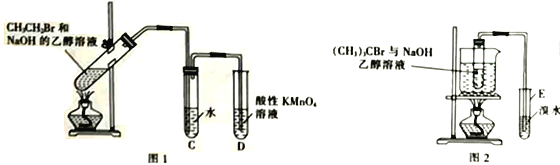
(2)乙同学用图2所示装置研究(CH3)3CBr与NaOH的乙醇溶液的反应。
①采用水浴加热的优点是_______________________________。
②发生反应后,试管E中的主要现象是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 a L Al2(SO4)3 和(NH4)2SO4 的混合溶液分成两等份,向其中一份加入 b mol BaCl2,恰好使溶液中 的 SO42-完全沉淀;向另一份加入足量强碱并加热可得到 c mol NH3,则原溶液中 Al3+的浓度(mol/L)为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用漂白粉溶液浸泡过的有色布条,如果晾置在空气中,过了一段时间,其漂白效果会更好的原因可能是
A. 漂白粉被空气中的氧气氧化了 B. 漂白粉在空气中生成了较多量的 HClO
C. 有色布条被空气中的氧气氧化了 D. 漂白粉溶液蒸发掉部分水,其浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com