
| A | B | |||
| C | D | E |
| A. | 简单离子的半径:D>E>C>B | |
| B. | 氧化物对应的水化物的酸性:E-定强于D | |
| C. | B、D分别与氢元素形成的化合物的沸点:D>B | |
| D. | A的最高价氧化物的水化物能与A的氢化物反应生成离子化合物 |
分析 五种短周期元素在元素周期表中的相对位置如表所示,A、B处于第二周期,C、D、E处于第三周期,其中E的非金属性在同周期元素中最强,则E为Cl元素,则D为S、C为Al、A为N、B为O元素,据此结合元素周期律知识进行判断.
解答 解:五种短周期元素在元素周期表中的相对位置如表所示,其中E的非金属性在同周期元素中最强,E处于第三周期,则E为Cl元素,则D为S、C为Al、A为N、B为O元素,
A.B、C的离子具有2个电子层,核电荷数越大,离子半径越小,则离子半径B>C,D、E的离子含有3个电子层,D的核电荷数小于E,则离子半径D>E,所以正确的离子半径大小为:D>E>B>C,故A错误;
B.没有指出最高价氧化物对应水合物,则E对应酸不一定强于D,如次氯酸的酸性小于硫酸,故B错误;
C.B、D分别为O、S元素,对应氢化物分别为水和硫化氢,由于水分子中含有氢键,则水的沸点大于硫化氢,故C错误;
D.A的最高价氧化物的水化物为硝酸,A的氢化物为氨气,硝酸与氨气反应生成离子化合物硝酸铵,故D正确;
故选D.
点评 本题考查了原子结构与元素周期律的应用,题目难度中等,“E的非金属性在同周期元素中最强”为解答突破口,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 断裂X和Y的化学键所吸收的能量一定高于形成M和N的化学键所放出的能量 | |
| B. | X和Y的总能量一定高于M和N的总能量 | |
| C. | Y的能量一定高于N | |
| D. | 因为该反应为放热反应,故不必加热就可发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、NO3-、NH4+、Cl- | B. | Ba2+、HCO3-、NH4+、NO3- | ||
| C. | K+、Cu2+、Cl-、OH- | D. | Na+、CO32-、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HC1为强电解质,可推测HF也为强电解质 | |
| B. | NH4+为正四面体结构,可推测PH4+也为正四面体结构 | |
| C. | C02晶体是分子晶体,可推测Si02晶体也是分子晶体 | |
| D. | C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②>① | B. | ③>④ | C. | ①>④ | D. | ②=③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:Na+、K+、MnO4-、NO3- | |
| B. | pH=13的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 0.1mol•L-1NaClO溶液中:Na+、K+、I-、NO3- | |
| D. | 0.1mol•L-1FeCl3溶液中:NH4+、SCN-、Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
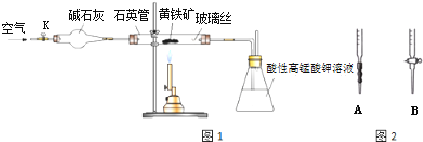
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com