
【题目】部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:下列说法正确的是( ) 
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中CuO的质量为4.0g
C.V=448
D.原样品中Fe元素的质量分数为41%
【答案】C
【解析】解:A.由于氧化性Fe3+>Cu2+>H+ , 铁离子优先反应,由于滤液A中不含铜离子,且硫酸足量,滤液A中阳离子为Fe2+、H+ , 故A错误; B.由于硫酸过量,生成氢气,滤液中不含铜离子,滤渣3.2g为金属铜,铜元素的物质的量为 ![]() =0.05mol,若全部为氧化铜,氧化铜的质量为:80g/mol×0.05mol=4.0g,由于部分铜被氧化成氧化铜,则样品中氧化铜的质量一定小于4.0g,故B错误;
=0.05mol,若全部为氧化铜,氧化铜的质量为:80g/mol×0.05mol=4.0g,由于部分铜被氧化成氧化铜,则样品中氧化铜的质量一定小于4.0g,故B错误;
C.滤液A中加入足量氢氧化钠溶液,所得滤渣灼烧得到的固体3.2g为Fe2O3 , 其物质的量= ![]() =0.02mol,铁元素的物质的量为0.04mol,滤液A中溶质为过量H2SO4和FeSO4 , 说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,合金中Fe元素质量=0.04mol×56g/mol=2.24g,故合金中氧原子的物质的量
=0.02mol,铁元素的物质的量为0.04mol,滤液A中溶质为过量H2SO4和FeSO4 , 说明参加反应硫酸物质的量为0.04mol,含氢离子0.08mol,其中部分氢离子生成氢气,另外的H+和合金中的氧结合成水了,合金中Fe元素质量=0.04mol×56g/mol=2.24g,故合金中氧原子的物质的量 ![]() =0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08mol﹣0.04mol=0.04mol H+生成氢气,即生成0.02mol氢气,标况体积=0.02mol×22.4L/mol=0.448L=448mL,故C正确;
=0.02mol,它结合氢离子0.04mol,所以硫酸中有0.08mol﹣0.04mol=0.04mol H+生成氢气,即生成0.02mol氢气,标况体积=0.02mol×22.4L/mol=0.448L=448mL,故C正确;
D.合金中Fe元素的质量为:56g/mol×0.04mol=2.24g,故合金中Fe元素质量分数= ![]() ×100%=38.89%,故D错误,
×100%=38.89%,故D错误,
故选C.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列几种物质:①MgCl2 ②H2O ③Al ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧I2 ⑨He
(1)只含有离子键的是(选填序号,下同)_______________;
(2)含有共价键的离子化合物是_____________;
(3)共价化合物是__________;
(4)熔融状态时和固态时,都能导电的是_______________;
(5)HClO的电子式____________。
(6)用电子式表示MgCl2的形成过程_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.所有原子的原子核都是由质子和中子构成的
B.氢离子(H ) 实质上是一个裸露的质子
C.核外电子排布相同的微粒, 其化学性质也相同
D.非金属元素原子最外层电子数都大于 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O42H2O)是一种浅黄色固体,难溶于水,受热易分解,是生产锂电池的原材料,也常用作分析试剂及显影剂等,其制备流程如下: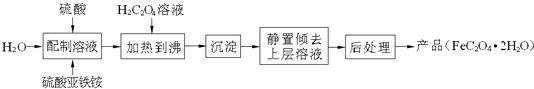
(1)配制(NH4)2Fe(SO4)26H2O溶液时,需加少量硫酸,目的是 .
(2)沉淀时发生反应的化学方程式为 .
(3)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液的颜色由紫红色变为棕黄色,同时有气体生成.这说明草酸亚铁晶体具有(填“氧化”或“还原”)性.若反应中消耗1mol FeC2O42H2O,则参加反应的n(KMnO4)为 .
(4)称取3.60g草酸亚铁晶体(摩尔质量是180gmol﹣1)用热重法对其进行热分解,得到剩余固体质量随温度变化的曲线如图所示: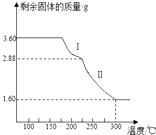
①过程Ⅰ发生反应的化学方程式为 .
②300℃时剩余固体是铁的一种氧化物,试通过计算确定该氧化物的化学式(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氯元素及其化合物的表示正确的是( )
A.质子数为17、中子数为20的氯原子 ![]() Cl
Cl
B.氯离子(Cl﹣)的结构示意图: 
C.氯分子的电子式: ![]()
D.氯乙烯分子的结构简式:H3C﹣CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质进行的分类正确的是( )
A.纯碱、烧碱都属于碱
B.结晶硫酸铜(CuSO4·5H2O)属于电解质
C.凡能电离出氢离子的化合物都属于酸
D.盐类物质一定含有金属阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)C8H8(g)+H2(g)△H>0 Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2[来源:] | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是 .
(2)该温度下,该反应的化学平衡常数是 .
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/kJmol1 | 412.5 | 348 | 612 | 436 |
(3)已知: 计算上述反应的△H=kJmol﹣1 . 若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是 . 此时,该反应是否达到了平衡状态?(填“是”或“否”).
Ⅱ.工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示.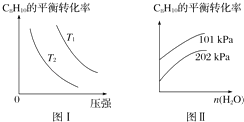
(4)由图Ⅰ可知,T1T2(填“大于”、“小于”或“等于”).
(5)由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将(填“越大”、“越小”或“不变”),原因是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com