
| 性状 | 熔点/℃ | 沸点/℃ | 水溶性 | |
| N2H4 | 无色液体 | 1.4 | 113 | 与水混溶 |
| N2H6SO4 | 无色晶体 | 254 | / | 微溶于冷水,易溶于热水 |
| 步骤 | 操作 | 现象 |
| Ⅰ | 取10g NaClO固体,加入100mL水 | 固体溶解,溶液呈碱性 |
| Ⅱ | 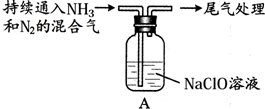 | 液面上方出现白雾 |
分析 (1)NaClO溶液中溶质是强碱弱酸盐,次氯酸根离子水解溶液呈碱性;
(2)①向肼的溶液中滴加石蕊试剂,溶液变蓝说明溶液显碱性,肼是一种二元弱碱,肼水溶液中电离出氢氧根离子;
②氨气也是碱性气体,用湿润的红色石蕊试纸检验,试纸变蓝;
(3)步骤II中反应是氨气被次氯酸钠溶液氧化生成肼;
(4)①洗涤液加入足量硝酸钡溶液静置后在上层清液中加入硝酸酸化的硝酸银溶液检验氯离子的存在;
②氯化钠随温度变化溶解度变化不大,提纯含有NaCl的N2H6SO4固体,可以利用重结晶法提纯;
③将N2H6SO4固体溶于KOH溶液反应生成肼,通过蒸馏分离出来;
解答 解:(1)NaClO溶液中溶质是强碱弱酸盐,次氯酸根离子水解溶液呈碱性,离子方程式为:ClO-+H2O?HClO+OH-,
故答案为:ClO-+H2O?HClO+OH-;
(2)①向肼的溶液中滴加石蕊试剂,溶液变蓝说明溶液显碱性,肼是一种二元弱碱,肼水溶液中电离出氢氧根离子,电离方程式为:N2H4+H2O?N2H5++OH-,
故答案为:N2H4+H2O?N2H5++OH-;
②向水中持续通入NH3,未观察到白雾,推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝.该实验不能判断白雾中含有N2H4,故氨气也是碱性气体,用湿润的红色石蕊试纸检验,试纸变蓝,
故答案为:白雾中混有NH3,NH3也可以使湿润的红色石蕊试纸变蓝;
(3)步骤II中反应是氨气被次氯酸钠溶液氧化生成肼,反应的化学方程式为:2NH3+NaClO═N2H4+NaCl+H2O,
故答案为:2NH3+NaClO═N2H4+NaCl+H2O;
(4)①洗涤液加入足量硝酸钡溶液显沉淀硫酸根离子,静置后在上层清液中加入硝酸酸化的硝酸银溶液检验氯离子的存在,检验Cl-操作是;取少量洗涤后的滤液放入试管中,加入足量Ba(NO3)2溶液振荡,静置后,在上层清液中继续加入硝酸酸化的AgNO3溶液,若无白色沉淀产生,则无Cl-,
故答案为:取少量洗涤后的滤液放入试管中,加入足量Ba(NO3)2溶液振荡,静置后,在上层清液中继续加入硝酸酸化的AgNO3溶液,若无白色沉淀产生,则无Cl-;
②氯化钠随温度变化溶解度变化不大,N2H6SO4溶解度随温度变化大,提纯含有NaCl的N2H6SO4固体,可以利用重结晶法提纯,
故答案为:重结晶;
③将N2H6SO4固体溶于KOH溶液反应生成肼,肼的沸点为113°C,通过蒸馏分离出来,
故答案为:蒸馏;
点评 本题考查了物质性质的分析判断,溶液酸碱性,物质酸碱性判断,实验设计,实验基本操作和物质性质是解题关键,题目难度中等.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 LSO2含有的氧原子数均为1.5NA | |
| B. | 17g NH3中所含原子数为4NA | |
| C. | 23g Na在化学反应中失去的电子数目为NA | |
| D. | 标准状况下,分子数目为NA氯气所占的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中滴入AgNO3溶液,生成白色沉淀,该溶液中可能含Cl- | |
| B. | 实验已经证明,氯水是可以导电的,所以氯水是电解质 | |
| C. | 某溶液与淀粉碘化钾溶液反应后出现蓝色,则证明该溶液是氯水 | |
| D. | 胶体与其它分散系的本质区别在于胶体具有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用焰色反应鉴别NaCl、KCl | |
| B. | 用氢氧化钠溶液鉴别MgCl2溶液、AlCl3溶液 | |
| C. | 利用稀硫酸鉴别SiO2与Al2O3固体 | |
| D. | 用氢氧化钙溶液鉴别Na2CO3和NaHCO3两种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备溴乙烷并进行溴乙烷的性质实验如下,试回答下列问题:
实验室制备溴乙烷并进行溴乙烷的性质实验如下,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石晶体中的最小碳原子环由6个碳原子构成 | |
| B. | SO3晶体属于原子晶体 | |
| C. | 1molSiO2晶体中含有2molSi-O键 | |
| D. | 金刚石化学性质稳定,即使高温下也不会和O2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干燥的Cl2和氯水均能使鲜花褪色 | |
| B. | SiO2具有导电性,可用于制造半导体材料 | |
| C. | 某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ | |
| D. | Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com