
| A.0.9 mol/L | B.0.85 mol/L | C.0.8 mol/L | D.0.75 mol/L |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源:不详 题型:填空题
| | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀pH | ≥9.6 | ≥6.4 | ≥3.2 |
 [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
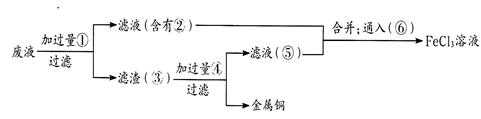
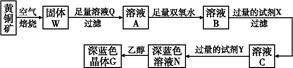
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CuSO4和1.0 mol
CuSO4和1.0 mol H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:
H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算: 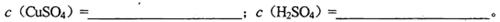

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
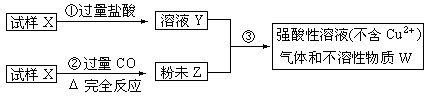
| A.氢气 | B.焦炭 | C.氯气 | D.氧气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
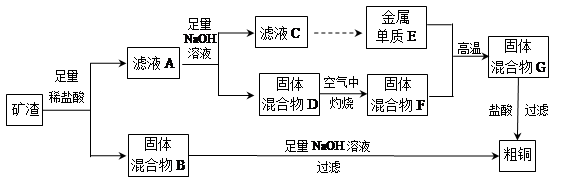
| A.氢氧化钠溶液 | B.硫酸溶液 | C.氨水 | D.二氧化碳 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
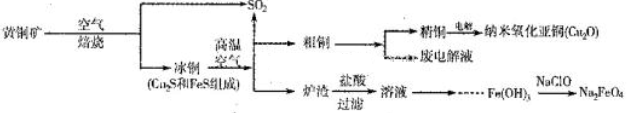
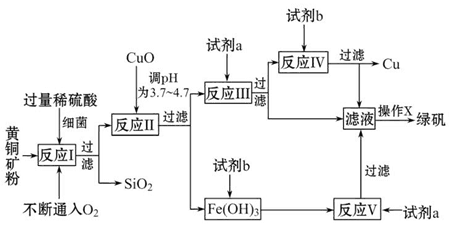
 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。 Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
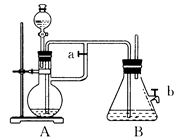
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com