
【题目】下列关于合金的说法中错误的是 ( )
A. 多数合金的硬度一般比其各成分金属的硬度高
B. 多数合金的熔点一般比其各成分金属的熔点低
C. 合金的物理性质一般与其各成分金属的物理性质有所不同
D. 合金的化学性质一般与其各成分金属的化学性质完全不同
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=l0c2
C. pH =11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. NaHCO3溶液中有:HCO3-+H2O![]() CO32-+H3O+加水稀释后,H+浓度减小
CO32-+H3O+加水稀释后,H+浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是(括号内的是杂质)( )
A.N2(CO):通过灼热的CuO粉末
B.SO2 (HCl):通入饱和碳酸氢钠溶液中
C.NaCl(NH4Cl):加热
D.NO2(NO):通入水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g) ![]() CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
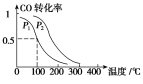
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式________________。
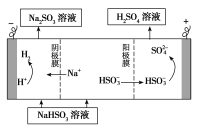
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】构成月季和孔雀的主要化学元素有
A.C、H、O、S、N、PB.C、H、O、N、P、Fe
C.N、P、K、Ca、S、ZnD.H、O、K、S、P、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,3.4 g D2O2所含极性键数目为0.2NA
B. 25℃,pH =2的H2SO4溶液中,H+的数目为0.02 NA
C. 标准状况下,2.24 L CCl4含有的分子数目为0.1NA
D. lmol OH-含有的电子数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分是Cu2(OH)2CO3,受热分解生成三种氧化物,并有如图所示的转化关系:
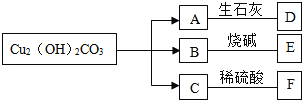
回答问题:
(1)D在农业生产中的用途是__________________;
(2)写出碱式碳酸铜受热分解的化学方程式:____________________;
(3)D和E反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘与氢气反应的有关热化学方程式如下,下列说法正确的是
① I2(g)+H2(g) ![]() 2HI(g) △H=-9.48 kJ·mol–1
2HI(g) △H=-9.48 kJ·mol–1
② I2(s)+H2(g) ![]() 2HI(g) △H=+26.48 kJ·mol–1
2HI(g) △H=+26.48 kJ·mol–1
A.①的产物比②的产物稳定
B.②的反应物总能量比①的反应物总能量低
C.I2(s) ![]() I2(g) △H=+17.00 kJ·mol–1
I2(g) △H=+17.00 kJ·mol–1
D.在装有1mol I2(g)的密闭容器中通入1 mol H2(g),发生反应时放热9.48 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com