
按要求回答下列问题:
(1)向CH
3COOH水溶液中加入适量NaCl溶液,平衡CH
3COOH?H
++CH
3COO
-将向
(填“正反应方向”、“逆反应方向”或“不”)移动,达到新的平衡状态时,溶液中c(CH
3COO
-)与原平衡时相比
(填“增大”、“减小”或“不变”),溶液中c(OH
-) 与原平衡时相比
(填“增大”、“减小”或“不变”).
(2)①K通常表示化学平衡常数,对于反应Cl
2+H
2O?H
++Clˉ+HClO其化学平衡常数K的表达式为:
.
②在25℃下,将a mol?L
-1的氨水与0.01mol?L
-1的盐酸等体积混合,反应平衡时溶液中c(NH
)=c(Cl
-),试用含a的代数式表示此时溶液中NH
3?H
2O的电离常数K
b=
.
(3)常温下,向一定体积的0.1mol?L
-1的醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H
+)亦增大
C.溶液中
| c(CH3COO-) |
| c(CH3COOH)?c(OH-) |
不变
D.溶液中
减小
(4)①常温下将0.15mol?L
-1的稀硫酸V
1 mL与0.1mol?L
-1的NaOH溶液V
2 mL混合,所得溶液的pH为1,则V
1:V
2=
(溶液体积的变化忽略不计,硫酸在水中电离方程式:H
2SO
4=2H
++SO
42-).
②常温下若溶液由pH=3的一元酸HA水溶液V
1 mL与pH=11的NaOH水溶液V
2 mL混合而得,则下列说法正确的是
A.若混合后溶液呈中性,则c(H
+)+c(OH
-)=2×10
-7 mol?L
-1B.若V
1=V
2,混合后溶液的pH一定等于 7
C.若混合后溶液呈酸性,则V
1一定大于V
2D.若混合后溶液呈碱性,则V
1一定小于V
2(5)NH
4HSO
4在分析试剂、医药、电子工业中用途广泛.现向100mL 0.1mol?L
-1NH
4HSO
4溶液中滴加0.1mol?L
-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.试分析图中a~e 5个点,并回答下列问题:
①水的电离程度最大的是
点;
②在c点,溶液中各离子浓度由大到小的排列顺序是
.

 按要求回答下列问题:
按要求回答下列问题:

 天天练口算系列答案
天天练口算系列答案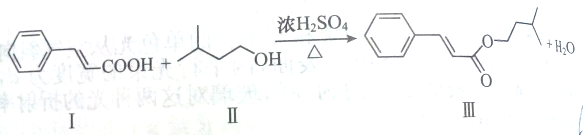
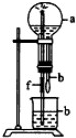 如图,烧瓶中充满干燥气体a,胶头滴管及烧杯中均为液体b,挤压胶头滴管,然后打开弹簧夹f,烧瓶中出现喷泉,最后烧瓶充满b.下列不符合上述条件的是( )
如图,烧瓶中充满干燥气体a,胶头滴管及烧杯中均为液体b,挤压胶头滴管,然后打开弹簧夹f,烧瓶中出现喷泉,最后烧瓶充满b.下列不符合上述条件的是( ) 