
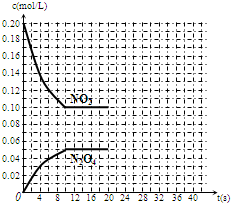
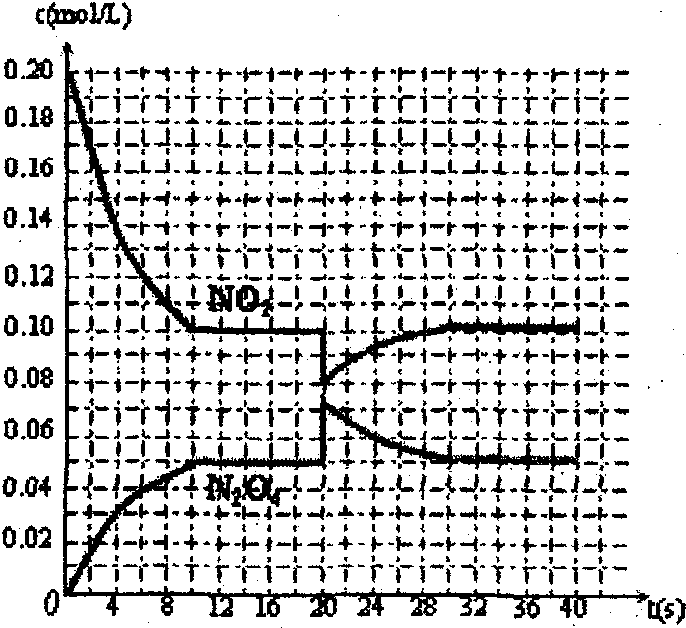
 在30℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,经过10s达到平衡,浓度变化曲线如图所示,试回答:
在30℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,经过10s达到平衡,浓度变化曲线如图所示,试回答:| △c |
| t |
| [N2O4] |
| [NO2]2 |
| △c |
| t |
| 0.10mol/L |
| 10s |
| [N2O4] |
| [NO2]2 |
| 0.05 |
| 0.12 |
| 0.40mol |
| 2L |
| (0.40+0.075×2)mol |
| V |
| 0.30mol |
| 2L |
| (0.30+0.075)mol |
| V1 |
| 0.20mol |
| 2.5L |
| 0.175 mol |
| 2.5L |
 ;
; ;
;

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
| 时间/s c/mol?L-1 |
0 | 20 | 40 | 60 | 80 | 100 |
| N2O4 | 0.20 | a | 0.10 | c | d | e |
| NO2 | 0 | 0.12 | b | 0.26 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 30 | 60 | 90 |
| n(L)/mol | 0.80 | a | b | c |
| n(M)/mol | 0.00 | 0.10 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 时间/s c/mol?L-1 |
0 | 20 | 40 | 60 | 80 | 100 |
| N2O4 | 0.20 | a | 0.10 | c | d | e |
| NO2 | 0 | 0.12 | b | 0.26 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源:2010年山东省济宁二中高考化学一模试卷(解析版) 题型:解答题
| 时间/s c/mol?L-1 | 20 | 40 | 60 | 80 | 100 | |
| N2O4 | 0.20 | a | 0.10 | c | d | e |
| NO2 | 0.12 | b | 0.26 | 0.30 | 0.30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com