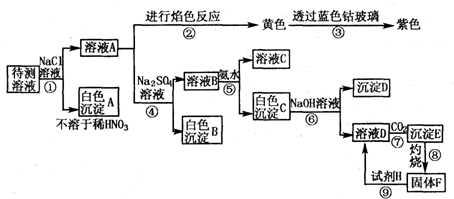
某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+,Ba2+中的几种离子.
(1)不做任何实验就可以肯定原溶液中不存在的离子是______.
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有的离子是______,有关的离子反应式为______.
(3)取(2)的滤液加入过量KHSO4溶液,出现白色沉淀,说明原溶液中肯定存在的离子有______,有关离子方程______.
(4)取(3)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有______.
(5)原溶液中可能大量存在的阴离子是下列A-D中的(填序号)______.
A.Cl- B.NO3- C.CO32- D.OH-.
解:(1)由于溶液呈无色透明,而Cu2+有颜色,可以肯定原溶液中不存在Cu2+,故答案为:Cu2+;
(2)过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定有Ag+离子,反应的离子方程式为Ag++Cl-═AgCl↓,
故答案为:Ag+;Ag++Cl-═AgCl↓;
(3)加入过量KHSO4溶液,出现白色沉淀,应为BaSO4,反应的离子方程式为Ba2++SO42-═BaSO4↓,
故答案为:Ba2+;Ba2++SO42-═BaSO4↓;
(4)在除去Ag+离子的溶液中,加入过量NaOH溶液,出现白色沉淀,则原溶液中一定存在Mg2+,
故答案为:Mg2+;
(5)由于Cl-和Ag+离子,CO32-、OH-与Mg2+、Ba2+都能生成沉淀,只有NO3-与Ag+、Mg2+、Ba2+不生成沉淀,故原溶液中可能大量存在的阴离子是NO3-,
故答案为:B.
分析:无色透明溶液,说明原溶液中不存在Cu2+,加入过量稀盐酸,生成不溶于稀硝酸的白色沉淀为AgCl,过量KHSO4溶液,出现白色沉淀,应为BaSO4,加入过量NaOH溶液,出现白色沉淀,应为Mg(OH)2,以此进行分析.
点评:本题考查离子的检验和离子共存问题,题目难度中等,注意常见离子的性质和检验方法.



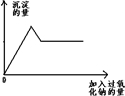 某无色透明溶液中可能含Mg2+、Al3+、Fe3+、Cu2+、NH4+、K+中的几种离子.当加入过量的过氧化钠时,有无色无味的气体产生,同时生成白色沉淀.加入的过氧化钠的量与产生沉淀的量之间的关系如右图所示,试回答:
某无色透明溶液中可能含Mg2+、Al3+、Fe3+、Cu2+、NH4+、K+中的几种离子.当加入过量的过氧化钠时,有无色无味的气体产生,同时生成白色沉淀.加入的过氧化钠的量与产生沉淀的量之间的关系如右图所示,试回答: