
����Ŀ��ij��Һ���ܺ���Cl����SO42����CO32����HCO3����NH4+��Fe3+��Ba2+��K+ �� ȡ����Һ100mL���������NaOH��Һ���ȣ��õ�0.02mol���壬ͬʱ����1.97g��ɫ��������������Һ�м�����BaCl2��Һ��Ҳ�õ�1.97g�������ɴ˿�֪ԭ��Һ�У� ��
A.���ٴ���5������
B.Cl��һ�����ڣ���c��Cl������0.2mol/L
C.SO42����NH4+��Fe3+һ�����ڣ�Al3+��K+��Cl�����ܴ���
D.CO32��һ�������ڣ�SO42����NH4+��Fe3+��Cl��һ������
���𰸡�B
���������⣺ij��Һ���ܺ���Cl����SO42����CO32����HCO3����NH4+��Fe3+��Ba2+��K+ �� ȡ����Һ100mL���������NaOH��Һ���ȣ��õ�0.02mol���壬�ж�Ϊ������NH4++OH��=NH3��+H2O����Һ��һ����NH4+ �� ���ʵ���Ϊ0.02mol��ͬʱ����1.97g��ɫ������������֪��Һ��һ����Ba2+ �� ��һ������SO42����CO32����Fe3+ �� ��ɫ����ΪBaCO3 �� ��̼��������Ӻ��������Ʒ�Ӧ����̼������ӽ�ϱ��������ɵ�̼�ᱵ��ɫ��������������Һ�м�����BaCl2��Һ��Ҳ�õ�1.97g������̼�ᱵ��������̼������������ʵ���= ![]() +
+ ![]() =0.02mol��ԭ��Һ��Ba2+���ʵ���=
=0.02mol��ԭ��Һ��Ba2+���ʵ���= ![]() =0.01mol�������Һ�е���غ�����ж����������Ƿ���ڣ������ӣ�n��NH4+��+2n��Ba2+��=0.02mol+2��0.02mol=0.06mol��n��HCO3����=0.02mol����һ����Cl�����ʵ�������Ϊ0.02mol��K+���ܺ��У�
=0.01mol�������Һ�е���غ�����ж����������Ƿ���ڣ������ӣ�n��NH4+��+2n��Ba2+��=0.02mol+2��0.02mol=0.06mol��n��HCO3����=0.02mol����һ����Cl�����ʵ�������Ϊ0.02mol��K+���ܺ��У�
A��������֪һ�����е�����HCO3����NH4+��Ba2+��Cl�� �� ���ܺ�K+ �� ������Һ�����ٴ���4�����ӣ���A����
B��������Һ�е�ɷ�����֪�������ӣ�n��NH4+��+2n��Ba2+��=0.02mol+2��0.02mol=0.06mol��n��HCO3����=0.02mol����һ����Cl�����ʵ�������Ϊ0.02mol��Cl��һ�����ڣ�K+���ӿ��ܺ��У�������Ũ������Ϊ��c��Cl������ ![]() =0.2mol/L����B��ȷ��
=0.2mol/L����B��ȷ��
C��SO42����Fe3+һ�������ڣ�K+��Cl�����ܴ��ڣ�NH4+һ�����ڣ���C����
D��CO32��һ�������ڣ�HCO3����NH4+��Ba2+��Cl��һ�����ڣ�SO42����Fe3+һ�������ڣ���D����
��ѡB��
ij��Һ���ܺ���Cl����SO42����CO32����HCO3����NH4+��Fe3+��Ba2+��K+ �� ȡ����Һ100mL���������NaOH��Һ���ȣ��õ�0.02mol���壬�ж�Ϊ������NH4++OH��=NH3��+H2O����Һ��һ����NH4+ �� ���ʵ���Ϊ0.02mol��ͬʱ����1.97g��ɫ������������֪��Һ��һ����Ba2+ �� ��һ������SO42����CO32����Fe3+ �� ��ɫ����ΪBaCO3 �� ��̼��������Ӻ��������Ʒ�Ӧ����̼������ӽ�ϱ��������ɵ�̼�ᱵ��ɫ��������������Һ�м�����BaCl2��Һ��Ҳ�õ�1.97g������̼�ᱵ��������̼������������ʵ���= ![]() +
+ ![]() =0.02mol��ԭ��Һ��Ba2+���ʵ���=
=0.02mol��ԭ��Һ��Ba2+���ʵ���= ![]() =0.01mol�������Һ�е���غ�����ж����������Ƿ���ڣ������ӣ�n��NH4+��+2n��Ba2+��=0.02mol+2��0.02mol=0.06mol��n��HCO3����=0.02mol����һ����Cl�����ʵ�������Ϊ0.02mol��K+���ܺ��У�����ѡ������жϣ�
=0.01mol�������Һ�е���غ�����ж����������Ƿ���ڣ������ӣ�n��NH4+��+2n��Ba2+��=0.02mol+2��0.02mol=0.06mol��n��HCO3����=0.02mol����һ����Cl�����ʵ�������Ϊ0.02mol��K+���ܺ��У�����ѡ������жϣ�


 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����ӻ������У��������������ӵİ뾶֮��������
A.KClB.NaBrC.LiID.KF
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�д��ڴ�����NH4+��Ba2+��Cl-������Һ�л����ܴ������ڵ�������
A. OH- B. SO42- C. Ag+ D. K+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ʱ��ֻ�ı�ijһ��������ѧ��ӦaA(g)+B(g)![]() cC(g)��ƽ��ı仯ͼ������(ͼ��p��ʾѹǿ��T��ʾ�¶ȣ�n��ʾ���ʵ���������ʾƽ��ת����)���ݴ˷�������˵����ȷ����
cC(g)��ƽ��ı仯ͼ������(ͼ��p��ʾѹǿ��T��ʾ�¶ȣ�n��ʾ���ʵ���������ʾƽ��ת����)���ݴ˷�������˵����ȷ����

A. ��ͼ��Ӧ���У�˵������ӦΪ���ȷ�Ӧ
B. ��ͼ��Ӧ���У���p1>p2����˷�Ӧ�Ħ�S>0
C. ��ͼ��Ӧ���У�˵��������ӦΪ���ȷ�Ӧ
D. ��ͼ��Ӧ���У���T1>T2����÷�Ӧ���Է�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������ȡ������Cl2������˵������ȷ����
A. ʵ��ǰ��������װ�õ�������
B. ֻ��ʹ�ö������̺�Ũ������ȡ
C. ������ʹ�ü�ʯ�Ҹ�������
D. ʹ�������ſ������ռ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(H3PO3)�Ƕ�Ԫ�ᣬH3PO3��Һ���ڵ���ƽ�⣺H3PO3![]() H++ H2PO3����������������NaOH��Һ��Ӧ������Na2HPO3��
H++ H2PO3����������������NaOH��Һ��Ӧ������Na2HPO3��
��1��д��������������NaOH��Һ��Ӧ�����ӷ���ʽ��____________________��
��2��ij�¶��£�0.100 0 mol��L-1��H3PO3��ҺpH�Ķ���Ϊ1.6������ʱ��Һ��c(H+)=2.5��10-2mol��L-1����OH-֮���������ӵ�Ũ���ɴ�С��˳����______________________�����¶���H3PO3����ƽ���ƽ�ⳣ��K=________��(H3PO3�ڶ���������Բ��ƣ����������λ��Ч����)
��3����H3PO3��Һ�еμ�NaOH��Һ�����ԣ�������Һ��c(Na+)________c(H2PO3��)+2c(HPO32��)(����>����<������=��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʣ���NaCl ��K2SO4 ��AlCl3 ��CuSO4 ��CH3COOH ������ �� BaSO4 ��NaOH��Һ
��1��������������������ʵ���________�������,��ͬ�����ܵ����������______
��2����������AlCl3ˮ��Һ�����գ��õ����ʵĻ�ѧʽΪ___________��
��3��д��CuSO4��Һ��ˮ�����ӷ�Ӧ����ʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������NOx���Ǵ�����Ⱦ��֮һ����ҵ����һ���¶Ⱥʹ�����������NH3��NOx��ԭ����N2 �� ijͬѧ��ʵ�����ж�NH3��NOx��Ӧ������̽�����ռ�����NH3����ע����X�У�Ӳ�ʲ�����Y�м�����������������NO2�������ü���K1��K2�кã�����һ���¶��°�ͼʾװ�ý���ʵ�飮 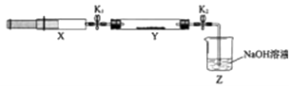
�������� | ʵ������ | ����ԭ�� |
��K1 �� �ƶ�ע����������ʹX�е����建��ͨ��Y���� | ��Y���� | �ڷ�Ӧ�Ļ�ѧ����ʽ |
��ע���������˻�ԭ�����̶�����װ�ûָ������� | Y����������ˮ�� | ���ɵ���̬ˮ���� |
��K2 | �� | �� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com