
| A、①② | B、②③ | C、①④ | D、③ |
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
| 10 |
| 3 |
| 2 |
| 3 |


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物 |
| B、可用Na2O2除去N2中的水蒸气 |
| C、过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂 |
| D、过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、I2具有氧化性 |
| B、该反应属于氧化还原反应 |
| C、氧化剂是KClO3 |
| D、I2是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一部分为Al(OH)3,一部分为Al3+ |
| B、全部为Al(OH)3 |
| C、一部分为Al(OH)3,一部分为AlO2- |
| D、全部为AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
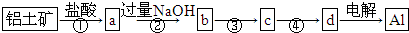
| A、①②中除加试剂外,还需要进行过滤操作 |
| B、a、b中铝元素的化合价不相同 |
| C、③中需要通入过量的CO2 |
| D、④进行的操作是加热,而且d一定是氧化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.
金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为: |
| (2)将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为: |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2 (标准状况),若与足量金属钠反应则生成2.24L H2(标准状况 ) | (3)写出A中含有的官能团: |
(4)A的核磁共振氢谱如图: | (4)A中含有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合溶液中由水电离出的c(H+)=1×10-5mol/L |
| B、c(A-)+c(HA)=2c(Na+)=0.4 mol/L |
| C、c(HA)>c(A-)>c(Na+)>c(H+)>c (OH-) |
| D、c(A-)-c(HA)=2c(H+)-2 c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com