
【题目】元素周期表第四周期的8、9、10列元素为X、Y、Z,它们的化合物在生产生活中有着广泛的应用。回答下列问题(涉及的化学式用元素符号表示)
(1)基态X原子的价电子排布式为______________________,Z2+核外3d能级上有___________对成对电子。
(2)Y3+的一种配离子[Y(N3) (NH3)5]2+中,Y3+的配位数是___________,lmol配离子中所含σ键的数目为___________,配位体N3-中心原子杂化类型为______________________。
(3)Y2+在水溶液中以[Y(H2O)6]2+存在。向含Y2+的溶液中加入过量氨水可生成更稳定的[Y(NH3)6]2+,其原因是____________________________________________。
(4)X离子与KCN形成的蓝色晶体中,X2+、X3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为______________________,立方体中X2+间连接起来形成的空间构型是____________________。
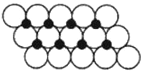
(5)一定温度下,ZO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Z2+填充其中(如图),已知O2-的半径为apm,每平方米面积上分散的该晶体的质量为___________g(用含a、NA的代数式表示)。
【答案】3d64s2 3 6 23NA sp N元素电负性比O元素小,N原子更容易提供孤电子对,形成配位键更稳定 KFe2(CN)6 正四面体形 ![]() 或
或![]()
【解析】
元素周期表第四周期的8、9、10列元素为X、Y、Z,推出X为Fe,Y为Co,Z为Ni,然后进行分析;
元素周期表第四周期的8、9、10列元素为X、Y、Z,推出X为Fe,Y为Co,Z为Ni,
(1)基态Fe原子价电子是由最外层s能级和次外层d能级组成,则基态Fe原子价电子排布式为3d64s2;Ni2+的价电子排布式为3d8,有3对成对电子;
(2)该配离子为[Co(N3)(NH3)5]2+,Co3+的配位数为6,成键原子之间只能形成一个σ键,1mol该配离子含有σ键的数目是23NA;N3-可以看作是(NN2)-,有2个σ键,孤电子对数为(5+1-2×3)/2=0,杂化类型为sp;
(3)N元素电负性比O元素小,N原子更容易提供孤电子对,形成配位键更稳定;
(4)晶胞中Fe2+个数为4×1/8=1/2,Fe3+的个数为4×1/8=1/2,CN-个数为12×1/4=3,根据化合价代数和为0,则K+个数为1/2,即该晶体的化学式为KFe2(CN)6;Fe2+间接连起来,构成空间构型为正四面体形;
(5)建立如图所示结构, ,每个氧化镍所占的面积为2a×10-12×2a×10-12×sin60°m2,质量为75/NAg,因此每平方米含有的氧化镍的质量为
,每个氧化镍所占的面积为2a×10-12×2a×10-12×sin60°m2,质量为75/NAg,因此每平方米含有的氧化镍的质量为![]() 或
或![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中发生反应:2CO(g)![]() C(s)+CO2(g)。
C(s)+CO2(g)。

①下列能说明该反应达到平衡的是___________。
A.CO和CO2的浓度之比为1∶1
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC![]() O键
O键
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,T℃时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一容积为2L的密闭容器中,发生如图所示的反应。已知X、Y、Z均为气体,请回答下列问题:
(1)物质Z在0~10min的平均反应速率______。
(2)物质X和Y在反应中的转化率之比为______。
(3)写出该反应的化学方程式:______。(物质用X、Y、Z表达)。
(4)若已知该反应体系达到平衡状态时,共放出热量76.8kJ,则该反应的△H=______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向0.1mol·L-1的 NH4HCO3溶液中逐渐加入0.1mol·L-1NaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量与起始物质的量比值)。根据图像,下列说法不正确的是
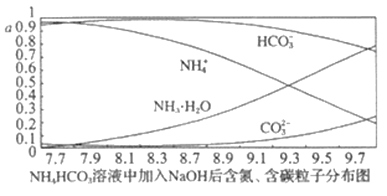
A. 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-=HCO3-+H2O
B. 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应
C. pH=9.5时,溶液中c(HCO3-)>c(NH3·H2O)>c(NH4+)>c(CO32-)
D. 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH===(NH4)2CO3+Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_________(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为H2SO4溶液,则氢氧燃料电池的正极反应式为__________________________________。该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气_________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图形象地表示了氯化钠的形成过程,下列相关叙述中,不正确的是( )
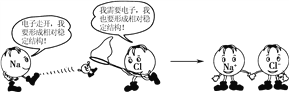
A. 钠原子易失去一个电子,氯原子易得到一个电子
B. 钠离子与钠原子有相似的化学性质
C. 钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D. 氯化钠是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应过程中能量变化的说法正确的是

A. 图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化
B. 己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2
C. 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D. 在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国企业华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2![]() C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是
C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是

A. 该电池若用隔膜可选用阴离子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe-=Li1-xCoO2+xLi+
D. 对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置完成了浓硫酸和SO2性质实验(夹持装置已省略):
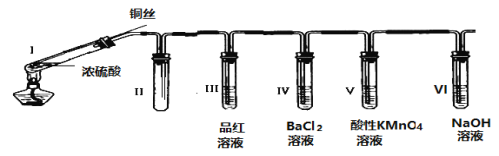
请回答:
(1)连接好装置后,接下来的操作步骤是________________
(2)浓硫酸与铜丝反应的化学方程式为________________
(3)装置II的作用是________________
(4)下列说法正确的是________________
A 反应一段时间后,向试管Ⅰ中的溶液加水,溶液呈蓝色
B 试管III、V中溶液都会褪色,其褪色原理相同
C 取下试管IV并不断振荡,试管中出现浑浊,是因为生成了BaSO4
D 试管VI中NaOH溶液用于吸收尾气,可用Na2CO3溶液代替
(5)某同学根据所学化学知识认为:反应完毕时,不管铜是否过量,硫酸一定有剩余。下列药品能证明反应结束时I试管中确有余酸的是________________
A BaCl2溶液 B 铁粉 C NaHCO3溶液 D 银粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com