
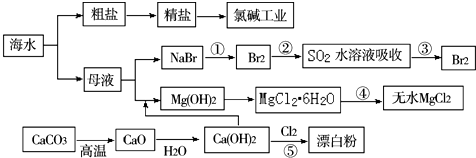
| A. | Cl2、漂白粉和SO2均可以漂白有色物质,且漂白的原理相同 | |
| B. | 氯碱工业就是指工业上电解饱和食盐水的方法制取NaOH、Cl2、H2的过程 | |
| C. | 工段④必须在干燥的HCl气流中加热才能制取无水MgCl2 | |
| D. | 工段①②③发生的反应均为氧化还原反应,且溴元素均被氧化 |
分析 A、Cl2、漂白粉的漂白原理是应用HClO的强氧化性,SO2的漂白原理是SO2与有色物质发生化合反应生成不稳定的无色物质;
B、工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业;
C、在干燥的HCl气流中加热氯化镁晶体可抑制氯化镁的水解;
D、工段②的反应中,溴元素化合价降低被还原;
解答 解:A、Cl2、漂白粉的漂白原理是应用HClO的强氧化性,属于氧化漂白,不可逆,SO2的漂白原理是SO2与有色物质发生化合反应,过程可逆,故A错误;
B、工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业,故B错误;
C、在干燥的HCl气流中加热氯化镁晶体可抑制氯化镁的水解,防止生成碱式氯化镁或氧化镁,故C正确;
D、工段①②③发生的反应均为氧化还原反应,工段①③是溴元素化合价升高,工段②的反应中,溴元素化合价降低被还原,故D错误;
故选C.
点评 本题以海水为载体,考查有关物质之间的相互转化及常见的化学工业,物质性质和工业生产流程是解题关键,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某白色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +43.5 | B. | -43.5 | ||
| C. | -67.7 | D. | +67.7(单位:kJ•mol-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用滴定管装标准液时应先水洗后用标准液润洗再装入标准液 | |
| B. | 锥形瓶用作反应容器时一定不能加热 | |
| C. | 蒸馏时温度计水银球可以高于蒸馏瓶支管口 | |
| D. | 萃取实验中振荡分液漏斗时,应关闭其玻璃塞并打开活塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
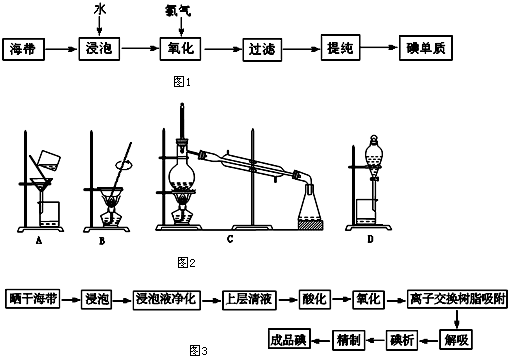
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 欧洲和北美洲的一些大城市上空二氧化氮浓度很高,其原因是这些地区硝酸工业发达 | |
| B. | 大气污染物中的二氧化硫能引起呼吸道疾病 | |
| C. | 天然的药物无任何毒副作用,可长期服用 | |
| D. | 长期食用二氧化硫含量超标的食品会破坏维生素B1,可通过服入碱性物质(如NaOH)的方法来消除二氧化硫中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
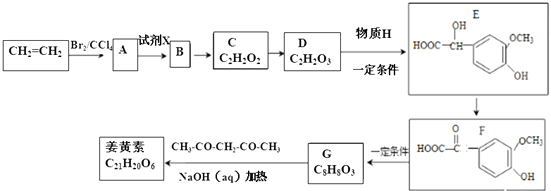
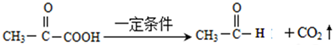

 .
.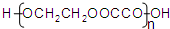 .
.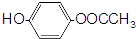 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com