
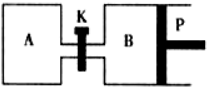
 �״�������ˮ������Ӧ������������Ӧ����ʽ���£�
�״�������ˮ������Ӧ������������Ӧ����ʽ���£����� ��1�����ݻ�ѧƽ������ʽ��ʽ���㣬����ѹǿ֮�ȵ������ʵ���֮�ȣ�
��2����ѧƽ��ı�־�����淴Ӧ������ͬ�������Ũ�ȱ��ֲ������ѡ�
��3�����ݺ��º��ݡ����º�ѹ�����仯����Ϸ�Ӧƽ�����������жϣ�ѹǿ�仯�����ʵ����仯�����ȣ���KAB��ɵ��Ǻ��º�ѹ����������ѹǿ�仯�����ʵ����仯�����ȼ���õ���
��� �⣺��1�����ݻ�ѧƽ������ʽ��ʽ���㣬�跴Ӧ�ļ״����ʵ���Ϊx
CH3OH��g��+H2O��g��?CO2��g��+3H2��g��
��ʼ����mol�� 1 3 0 0
�仯����mol�� x x x 3x
20s�� ��mol�� 1-x 3-x x 3x
20s��û�������ѹǿ�Ƿ�Ӧǰ��1.2����4+2x=1.2��4
x=0.4mol
v��CH3OH��=$\frac{\frac{0.4mol}{2L}}{20s}$=0.01mol/��L•s����
�ʴ�Ϊ��0.01mol/��L•s����
��2�����淴Ӧ�ﵽƽ��״̬�����������淴Ӧ������ͬ��
��v����CH3OH��=v����CO2���Ƿ�Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�����˵�㷴Ӧ�ﵽƽ�⣬�ʢٲ����ϣ�
�ڷ�Ӧǰ�������������䣬����������䣬��Ӧ�������ܶȲ��䣬���������ܶȲ��䲻��˵����Ӧ�ﵽƽ�⣬�ʢڲ����ϣ�
�۷�Ӧǰ���������ʵ������������غ㣬��������ƽ����Է����������䣬˵����Ӧ�ﵽƽ��״̬���ʢ۷��ϣ�
��CH3OH��H2O��CO2��H2��Ũ�ȶ����ٷ����仯��ƽ���־���ʢܷ��ϣ�
�ʴ�Ϊ���ۢܣ�
��3����B�����������Ϊԭ����1.5�������ӵ���������ʵ���Ϊ3.6 mol��0.5=1.8 mol�����ݻ�ѧ����ʽ��֪����2mol����Ӧ�״�1mol����Ӧ�ļ״������ʵ���Ϊ0.9 mol��CH3OH��ת����=$\frac{0.9mol}{1.2mol}$��100%=75%����Kʱ��AB���һ�����µ�ѹ��������Ӧ����ʼͶ�������ʵ�����ƽ�������������ȣ����K���´ﵽƽ����ܵ����Ϊx����x����3+3.6��=1.5a��3.6
���x=2.75a������B�����Ϊ2.75a-a=1.75a��
�ʴ�Ϊ��75%��1.75a��
���� ���⿼���˻�ѧƽ������ʽ���㣬ƽ���־�ķ����жϣ����º������������º�ѹ�����ķ����ж��ǽ���ؼ�������ѹǿ֮�Ⱥ����ʵ���֮�ȳ�����������Ŀ�Ѷ��еȣ�


 ���ʿ��ÿ��ֳɳ�ϵ�д�
���ʿ��ÿ��ֳɳ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ƼغϽ�ȴ��Ƶ��۵�� | |
| B�� | ����̼�������к��д���ķ����Ǽ��ȿ��Ƿ����������� | |
| C�� | Fe2O3����������ɫ�����Ϳ�� | |
| D�� | Cl2����Ư���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=2��HA��Һ��pH=12��MOH��Һ����Ȼ�ϣ�c��H+��+c��M+���Tc��OH-��+c��A-�� | |
| B�� | pH��ȵ�CH3COONa��NaOH��Na2CO3������Һ��c��NaOH����c��CH3COONa����c��Na2CO3�� | |
| C�� | ���ʵ���Ũ�����CH3COOH��CH3COONa��Һ�������ϣ�c��CH3COO-��+2c��OH-���Tc��H+��+c��CH3COOH�� | |
| D�� | 0.1mol•L-1��NaHA��Һ����pH=4��c��HA-����c��H+����c��H2A����c��A2-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �Զ��ױ� | B�� | 2-���� | C�� | 2-����ϩ | D�� | �����ױ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����0.1 mol•L-1 Fe3+����Һ�У�H+��Fe2+��Na+��I- | |
| B�� | ǿ������Һ�У�K+��Al3+��Cl-��SO42- | |
| C�� | ��pH=1����Һ�У�Mg2+��Na+��ClO-��NO3- | |
| D�� | ����ǿ���ټ��ȣ���������ų����г������ɵ���Һ��Ca2+��HCO3-��NH4+��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
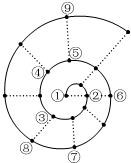 �����ǰ18��Ԫ�ذ�ԭ������������˳�����У����γ�ͼ��ʾ�ġ���ţ����״��ͼ��ÿ����•������һ��Ԫ�أ����Тٵ������Ԫ�أ������й�˵����ȷ���ǣ�������
�����ǰ18��Ԫ�ذ�ԭ������������˳�����У����γ�ͼ��ʾ�ġ���ţ����״��ͼ��ÿ����•������һ��Ԫ�أ����Тٵ������Ԫ�أ������й�˵����ȷ���ǣ�������| A�� | �����̬�⻯����ȶ��ԣ��۱Ȣ�ǿ���ݱȢ��� | |
| B�� | ����������Ӧˮ����ļ��ԣ��ڱȢ�ǿ | |
| C�� | �ߵ�����������Ӧ��ˮ����������� | |
| D�� | �����Ӱ뾶�ܱȢ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��H+��=c��CH3COO-�� | |
| B�� | ��Һ�У�c��H+����c��OH-�� | |
| C�� | CH3COOH���ӵ�Ũ�Ȳ��ٱ仯 | |
| D�� | ��Һ��ͬʱ����H+��CH3COO-��OH-��CH3COOH��H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com