
|
20℃时,将ag硝酸钾溶于bg水中,恰好形成VmL饱和溶液.下列关系式错误的是 | |
| [ ] | |
A. |
该溶液物质的量浓度c(KNO3)= |
B. |
该溶液的质量分数ω(KNO3)= |
C. |
20℃时硝酸钾的溶解度S= |
D. |
该溶液的密度ρ= |
科目:高中化学 来源: 题型:
(14分)某课外活动小组设计了以下实验方案探究Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
(1)测定NO的体积:
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验。
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
3→ (填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(2)测定硝酸的物质的量:反应结束后,从上图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,第一次滴定前后的滴定管中液面的位置如右图所示。请将读数填到表格的相应位置:
|
| 滴定前读读数/mL | 滴定后读数/mL |
| 第一次 |
|
|
| 第二次 | 0.10 | 18.00 |
| 第三次 | 0.20 | 18.30 |
依据表格的数据计算出在B容器中生成硝酸的物质的量为 mol。
(3)气体成份分析:
若实验测得NO的体积为93.0mL(已折算到标准状况),则Ag与浓硝酸反应过程中
(填“有”或“没有”)NO产生,作此判断的依据是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省漳州市芗城中学高二上学期期末考试化学试卷(带解析) 题型:填空题
按要求回答:
(1)写出电离方程式:
NaHCO3_______________________________________________________________________
H2S__________________________________________________________________________
(2)写出水解的离子方程式:
Na2CO3________________________________________________________________________
(3)用pH试纸测定0.1 mol·L-1的纯碱溶液的pH,其正确的操作是
__________________________________________________________________________________。
(4)氯化铝水溶液呈 性(填酸性、中性、碱性),原因是(用化学方程式表示):_____________________ _______________________________________________ ______ 。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(5)实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)Ag+水解。
(6)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有 ,其浓度由大到小的顺序为
,氨水的浓度a 0.01 mol·L-1(填“>”、“<”或“=”)。
(7)在25℃下,向浓度均为0.20 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 ;当测得溶液pH=11时,则此温度下残留在溶液中的c(Mg2+):c(Cu2+)= (已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.0×10-20)
查看答案和解析>>
科目:高中化学 来源:2014届福建省漳州市高二上学期期末考试化学试卷(解析版) 题型:填空题
按要求回答:
(1)写出电离方程式:
NaHCO3_______________________________________________________________________
H2S__________________________________________________________________________
(2)写出水解的离子方程式:
Na2CO3________________________________________________________________________
(3)用pH试纸测定0.1 mol·L-1的纯碱溶液的pH,其正确的操作是
__________________________________________________________________________________。
(4)氯化铝水溶液呈 性(填酸性、中性、碱性),原因是(用化学方程式表示):_____________________ _______________________________________________ ______ 。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(5)实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)Ag+水解。
(6)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有 ,其浓度由大到小的顺序为
,氨水的浓度a 0.01 mol·L-1(填“>”、“<”或“=”)。
(7)在25℃下,向浓度均为0.20 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 ;当测得溶液pH=11时,则此温度下残留在溶液中的c(Mg2+):c(Cu2+)= (已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.0×10-20)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年吉林省延吉市高三第六次月考(理综)化学部分 题型:实验题
(14分)某课外活动小组设计了以下实验方案探究Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
(1)测定NO的体积

①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是3→ (填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
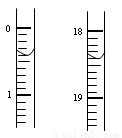
(2)测定硝酸的物质的量:反应结束后,从上图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,第一次滴定前后的滴定管中液面的位置如图所示。请将读数填到表格的相应位置
|
|
滴定前读读数/mL |
滴定后读数/mL |
|
第一次 |
|
|
|
第二次 |
0.10 |
18.00 |
|
第三次 |
0.20 |
18.30 |
依据表格的数据计算出在B容器中生成硝酸的物质的量为 mol。
(3)气体成份分析
若实验测得NO的体积为93.0mL(已折算到标准状况),则Ag与浓硝酸反应过程(填“有”或“没有”)NO产生,作此判断的依据是 。
查看答案和解析>>
科目:高中化学 来源:2010年黑龙江省高三第四次高考模拟考试化学试题 题型:实验题
(14分)某课外活动小组设计了以下实验方案探究Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:

(1)测定NO的体积:

①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验。
②选用如上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
3→ (填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置_______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(2)测定硝酸的物质的量:反应结束后,从上图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol·L-1的NaOH溶液滴定,用酚酞作指示剂,第一次滴定前后的滴定管中液面的位置如右图所示。请将读数填到表格的相应位置:

|
|
滴定前读读数/mL |
滴定后读数/mL |
|
第一次 |
|
|
|
第二次 |
0.10 |
18.00 |
|
第三次 |
0.20 |
18.30 |
依据表格的数据计算出在B容器中生成硝酸的物质的量为 mol。
(3)气体成份分析:
若实验测得NO的体积为93.0mL(已折算到标准状况),则Ag与浓硝酸反应过程中
(填“有”或“没有”)NO产生,作此判断的依据是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com