
分析 (1)根据“绿色化学”的特征:反应物中原子全部转化为欲制得的产物,即原子的利用率为100%;
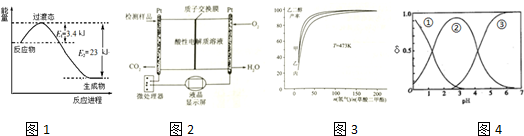
(2)①根据图1可知0.5mol CO2和1.5mol H2转化率达80%时放热23-3.4=19.6KJ,然后按比例计算:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的△H得出该反应的热化学方程式;
②化学平衡的标志是正逆反应速率相同,各组分浓度保持不变分析,注意恒容条件;
(3)甲醇为负极,被氧化生成二氧化碳和水;
(4)由图象可知,曲线甲表示的乙二醇的产率最大,原料投料比[n(氢气)/n(草酸二甲酯)]一定时,由方程式可知,正反应是体积减小的反应,增大压强平衡向正反应移动,平衡时乙二醇的产率增大,据此判断;
(5)根据图知,随着pH的增大,曲线1逐渐减小,说明其电离程度增大,为草酸;草酸为二元弱酸,草酸氢钾中草酸氢根离子水解;一定温度下,往CaC2O4饱和溶液中,存在CaC2O4(s)?C2O42-(aq)+Ca2+(aq)平衡,加入少量CaCl2固体,根据影响平衡移动的因素分析可得.
解答 解:(1)以CO与H2为原料,在一定条件下均可合成甲醇:CO(g)+2H2(g)$\stackrel{一定条件}{→}$CH3OH(g);以CO2与H2为原料,在一定条件下均可合成甲醇:CO2(g)+3H2(g) $\stackrel{一定条件}{→}$CH3OH(g))+H2O,以CO与H2为原料,产物只有一种,符合符合“绿色化学”的思想;
故答案为:CO(g)+2H2(g)$\stackrel{一定条件}{→}$CH3OH(g);
(2)①根据图1可知0.5mol CO2和1.5mol H2转化率达80%时放热23-3.4=19.6KJ,则该反应的热化学方程式:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-$\frac{19.6}{80%}$×2=-49kJ•mol-1;
故答案为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49 kJ•mol-1;
②a.该反应气体体积减小,在恒容容器中压强减小,不再改变说明达到了平衡状态,故a正确;
b.混合气体中 H2的体积分数不变,说明各组分的体积分数都不变,正逆反应速率,达到了平衡状态,故b正确;
c.c(H2)=3c(CH3OH)不能说明达到平衡状态,故c错误;
d.反应两边都是气体,气体总质量不变,恒压条件该容器的容积不变,故气体的密度不变,不能说明达到了平衡状态,故d错误;
(3)负极上燃料失电子和水反应生成氢离子和二氧化碳.电极反应式为:负极:CH3OH+H2O-6e-═6H++CO2,
故答案为:CH3OH+H2O-6e-═6H++CO2;
(4)由图象可知,曲线甲表示的乙二醇的产率最大,原料投料比[n(氢气)/n(草酸二甲酯)]一定时,由方程式可知,正反应是体积减小的反应,增大压强平衡向正反应移动,平衡时乙二醇的产率增大,故曲线甲对应的压强是P(丙)=1.5MPa,
故答案为:1.5MPa;
(5)根据图片知,随着pH的增大,曲线1逐渐减小,说明其电离程度增大,为草酸;
草酸氢钾溶液中有水的电离平衡、草酸氢根离子的水解及电离,故有:H2O?H++OH-,HC2O4-?H++C2O42-和H2O+HC2O4-?H2C2O4+OH-;
一定温度下,往CaC2O4饱和溶液中,存在CaC2O4(s)?C2O42-(aq)+Ca2+(aq)平衡,加入少量CaCl2固体,平衡逆向移动,c(C2O42-)将减小,c(Ca2+)不可抵消,所以c(Ca2+)增大,CaC2O4的溶解度将减小;
故答案为:H2C2O4;H2O+HC2O4-?H2C2O4+OH-;增大;减小.
点评 本题考查了热化学方程式书写,影响化学平衡的因素,图象分析、盐类水解和难溶电解质的溶解平衡,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质既能与强酸反应又能与强碱反应 | |
| B. | 该物质是Al(OH)3和Na2CO3的混合物 | |
| C. | 1 mol[NaAl(OH)2CO3]最多可消耗4 mol H+ | |
| D. | 该药剂不适合于胃溃疡患者服用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaCl溶液一定不能发生丁达尔效应 | |
| B. | 将1L2mol•-1FeCl3溶液制成胶体后,其中含有2NA个氢氧化铁胶粒(NA为阿伏加德罗常数值) | |
| C. | FeCl3溶液与Fe(OH)3胶体的本质区别是有无丁达尔效应 | |
| D. | 可吸入颗粒(如硅酸盐粉尘)形成气溶胶(分散剂为气体的胶体),对人体健康危害极大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方法 |
| A | 分离水和青蒿素 | 分液 |
| B | 分离乙醇和水 | 灼烧 |
| C | 分离碳酸钠和碳酸氢钠 | 过滤 |
| D | 除去碳酸钙中含有的少量氯化钙 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用淘米水浇花 | |
| B. | 农田普及滴灌技术 | |
| C. | 未及时修复破损的供水管道 | |
| D. | 工业废水经处理后作为城市绿化用水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢气在氯气中燃烧,火焰呈淡蓝色,瓶口出现大量暈白雾 | |
| B. | 将新制的氯气通入AgNO3溶液中,白色沉淀生成. | |
| C. | 铜在氯气中燃烧,产生大量棕色的烟,加水溶解后可得蓝绿色溶液 | |
| D. | 用洁净的铂丝沾取碳酸钾粉末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯能使酸性高锰酸钾溶液褪色,是因为乙烯分子中含有碳碳双键 | |
| B. | 甲烷和氢气都可以与氯气反应,且反应类型相同 | |
| C. | 用酸性重铬酸钾溶液检验酒驾,发生的反应属于乙醇的氧化反应 | |
| D. | 氨基酸分子中均含有羧基(-COOH)和氨基(-NH2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol | B. | 0.05 mol | C. | 1.05 mol | D. | 0.11 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com