
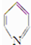
 )与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
)与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
| A. | M能使酸性高锰酸钾溶液褪色 | |
| B. | 1molM与金属钠反应,消耗2mol Na | |
| C. | 1mol磷酸吡醛与NaOH溶液反应,最多消耗3mol NaOH | |
| D. | M与足量H2反应后所得有机物的分子式为C8H17O3N |
分析 A.M中含-OH、-CHO均可被氧化;
B.磷酸吡醛中3个-OH均与Na反应;
C.磷酸吡醛水解生成M和磷酸,磷酸、吡啶环上的羟基均能与NaOH溶液反应;
D.M中-CHO及环状结构均与氢气发生加成反应.
解答 解:A.醇羟基、醛基等都能使酸性高锰酸钾溶液褪色,故A正确;
B.1 mol磷酸吡醛中含有2 mol-OH,故消耗金属钠2 mol,故B正确;
C.1 mol磷酸吡醛水解生成1 mol M和1 mol磷酸,又吡啶与苯环性质相似,故直接连在吡啶环上的羟基也能与NaOH溶液反应,即1 mol磷酸吡醛最多消耗4 mol NaOH,故C错误;
D.根据M的分子式为C8H9O3N,1 mol M可以消耗4 mol H2,故生成物分子式为C8H17O3N,故D正确;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物官能团与性质的关系为解答的关键,侧重醇、醛性质的考查,注意吡啶与苯环性质相似,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
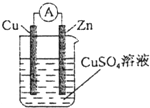
| A. | 铜棒为正极 | B. | 锌棒发生氧化反应 | ||
| C. | 电流从铜棒经外电路流向锌棒 | D. | 锌棒质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液 | B. | NaOH溶液 | C. | Ba(OH)2溶液 | D. | AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
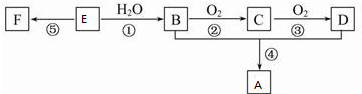
 ,反应类型加聚反应.
,反应类型加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
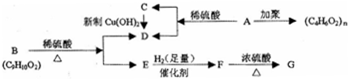
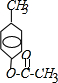 ;
;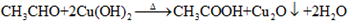 ,反应类型氧化反应;F→G
,反应类型氧化反应;F→G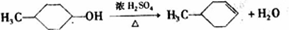 ,反应类型消去反应.
,反应类型消去反应.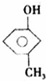 、
、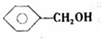 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
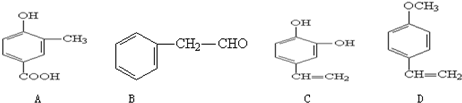
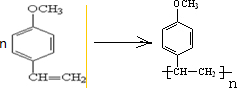
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3)(5) | B. | (1)(3)(4) | C. | (1)(2)(4)(5) | D. | (1)(2)(3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
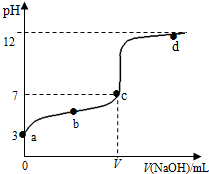 在常温下向20mL 0.1mol•L-1 某酸(用HA表示)溶液中逐滴加入0.1mol•L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化).请根据表中数据和滴定曲线回答以下问题:
在常温下向20mL 0.1mol•L-1 某酸(用HA表示)溶液中逐滴加入0.1mol•L-1 NaOH溶液,用pH计来测定溶液中pH数据如下表,作出pH与NaOH溶液体积关系的曲线如图所示(忽略温度变化).请根据表中数据和滴定曲线回答以下问题:| V(NaOH)mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| pH | 3.0 | 4.7 | 5.7 | 6.7 | 7.7 | 8.7 | 9.7 | 10.7 | 11.7 | 12.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com