
| A、决定反应速率快慢的因素是催化剂 |
| B、锌粉与稀硫酸反应时,加入少量铜粉能加快产生氢气的速率 |
| C、镁与稀盐酸反应时,加入少量水能加快产生氢气的速率 |
| D、已知:2SO2(g)+O2(g)?2SO3(g)△H=-197 kJ/mol,则2molSO2与 1molO2反应能放出197kJ热量 |


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
| A、所得的分散系属于悬浊液 |
| B、该分散系能产生丁达尔效应 |
| C、所得的分散系中分散质为Fe2O3 |
| D、所得分散系为胶体,且胶粒直径即为氢氧化铁分子直径 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积的关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:3:2 |
| B、图①中使用的NaOH的浓度为10 mol/L |
| C、图②表示25℃时,用0.1 mol?L-1盐酸滴定20 mL 0.1 mol?L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| D、图③中曲线表示3N2(g)+N2(g)?2NH3(g)反应过程的能量变化,若使用催化剂,B点会升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用SO2的漂白性可使酸性高锰酸钾溶液褪色 |
| B、漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂 |
| C、为便于储存和使用,可用液氯代替氯水漂白干燥棉布上的有色物质 |
| D、为增强漂白效果,可将等物质的量的SO2和Cl2混合使用以达到增强效果的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NA个HF分子所占的体积约为44.8L |
| B、常温常压下,8.8g CO2和N2O混合气体中所含的电子数为4.4NA |
| C、46g四氧化二氮和二氧化氮的混合气体中含有的原子数少于3NA |
| D、5.6g铁与500mL 2mol?L-1硝酸反应,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、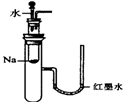 验证Na和水反应是否为放热反应 |
B、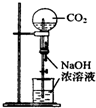 用CO2做喷泉实验 |
C、 观察纯碱的焰色反应 |
D、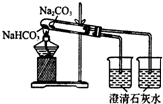 比较Na2CO3、NaHCO3的稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com