
下列图示与对应的叙述相符的是
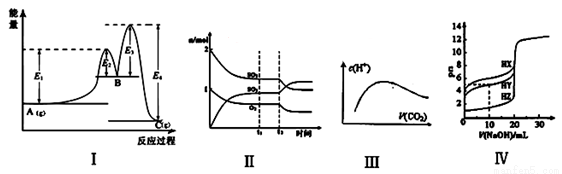
A.图Ⅰ中 可以看出反应A(g)=C(g)的△H=(E1-E4)kJ·mol-1
B.图Ⅱ表示一定条件下进行的反应2SO2+O2 2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
C.图Ⅲ表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系
D.图Ⅳ曲线表示用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
C
【解析】
试题分析:A、根据图Ⅰ可以看出反应A(g)=C(g)的△H=[E1-(E4—E3+E2)]kJ·mol-1,错误;B、反应2SO2+O2 2SO3 正向为气体体积减小的反应,扩大容器的体积,平衡逆向移动,二氧化硫和氧气的物质的量增大,三氧化硫的物质的量减小,与图像不符,错误;C、将CO2通入NaOH的稀溶液中,发生的反应依次为CO2+2NaOH====Na2CO3+H2O,Na2CO3 + CO2+ H2O====2NaHCO3,氢氧化钠抑制水的电离,而碳酸钠水解,促进水的电离,水的电离程度逐渐增大,碳酸氢钠的水解程度小于碳酸钠,碳酸抑制水的电离,水的电离程度又逐渐减小,与图像相符,正确;D、由图Ⅳ曲线可知,浓度相同的三种一元酸,HX的pH最大,电离程度最小,HX的酸性最弱,错误。
2SO3 正向为气体体积减小的反应,扩大容器的体积,平衡逆向移动,二氧化硫和氧气的物质的量增大,三氧化硫的物质的量减小,与图像不符,错误;C、将CO2通入NaOH的稀溶液中,发生的反应依次为CO2+2NaOH====Na2CO3+H2O,Na2CO3 + CO2+ H2O====2NaHCO3,氢氧化钠抑制水的电离,而碳酸钠水解,促进水的电离,水的电离程度逐渐增大,碳酸氢钠的水解程度小于碳酸钠,碳酸抑制水的电离,水的电离程度又逐渐减小,与图像相符,正确;D、由图Ⅳ曲线可知,浓度相同的三种一元酸,HX的pH最大,电离程度最小,HX的酸性最弱,错误。
考点:考查与化学相关的图像。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:2013-2014山西省5月月考高二化学试卷(解析版) 题型:填空题
(10分)按下面步骤由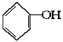 合成
合成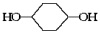 (部分试剂和反应条件已略去)。
(部分试剂和反应条件已略去)。

请回答下列问题:
(1)分别写出B、D的结构简式:B_________、D_________。
(2)反应①~⑦中属于消去反应的是 。(填数字序号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为:
(4)试写出C→D反应的化学方程式(注明反应条件)
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:填空题
实验题(14分):Ⅰ、HCOOH是一种无色、易挥发的液体,某学习小组参照: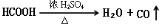 原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
(1)若所制气体流向从左向右时,上述仪器连接为: A→( ) →( )→( )→( ) →( )
(2)A装置中小试管的作用(至少答两条):
① 。② 。
(3)证明HCOOH受热产物中有CO的现象为: 。
(4)本实验有3处用到酒精灯,除A、B处外,还缺一个酒精灯,应放在 处.
Ⅱ、学习小组查阅资料知:
Cu的颜色为红色或紫红色,而Cu2O的颜色也为红色或砖红色。②4CuO 2 Cu2O + O2↑;③ Cu2O +2H+
2 Cu2O + O2↑;③ Cu2O +2H+
= Cu+Cu2+ + H2O ;因此对CO充分还原CuO后所得红色固体是否含有Cu2O进行了认真的研究,提出下列设计方案:
方案①:取该红色固体溶于足量稀硝酸中,观察溶液颜色的变化。
方案②:取该红色固体溶于足量稀硫酸中,观察溶液颜色的变化。
(5)写出Cu2O与稀硝酸反应的化学方程式: 。
(6)请你评价方案②的合理性,并简述理由:方案②: ,理由: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西大学附中高三第二学期5月理科综合化学试卷(解析版) 题型:选择题
已知常温下AgCl的Ksp=1.8×10-10,AgI的Ksp=8.5×10-17。若向5mL含有KCl和KI各为0.01mol/L的混合溶液中加入8mL 0.01mol/L AgNO3溶液,此时溶液中所含溶质的离子浓度大小关系正确的是
A.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-)
D.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-)
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省青岛市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(12分)【化学——物质结构与性质】
物质的结构决定性质,性质反映其结构特点。
(1)金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化;
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C;
c.晶体的熔点:金刚石< 石墨
d.晶体中共价键的键角:金刚石>石墨
(2)某石蕊的分子结构如图所示。
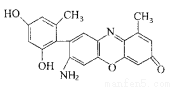
①石蕊分子所含元素中,基态原子2p轨道有两个成单电子的是 (填元素符号); 由其中两种元素形成的三角锥构型的一价阳离子是 (填化学式);
②该石蕊易溶解于水,分析可能的原因是 ;
(3)铜及其合金是人类最早使用的金属材料。
①NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 Cu NF3+3NH4F
上述化学方程式中的5种物质所属的晶体类型有_______(填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②金属铜采取如图所示堆积方式,可称为_____堆积,则Cu晶体中
Cu原子的配位数为
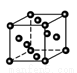
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省青岛市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
X、Y、Z、W是短周期元素,X为地壳中含量最高的金属元素;Y原子最外层电子数是电子总数的2/3;Z的最高正化合价与最低负化合价的代数和为4;W原子在短周期中原子半径最大。下列说法正确的是
A.ZO3和水反应形成的化合物是离子化合物
B.粘在试管内壁上的Z可以用YZ2洗涤
C.最高价氧化物对应水化物的碱性:X>W
D.X位于金属与非金属的分界线处,常用来做半导体材料
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省烟台市高三5月适应性测试一理综化学试卷(解析版) 题型:填空题
(16分)合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g) 2NH3(g)
2NH3(g)  H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:

①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡 移动、(填“向左”、“向右”或“不”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(H2)= 。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡 移动(填“向左”、“向右”或“不”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) H2O(1)+CO(NH2)2(1) △H,
H2O(1)+CO(NH2)2(1) △H,
在一定压强下测得如下数据:
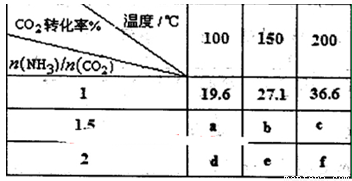
①则该反应△H 0,表中数据a d,b f(均选填“>”、‘‘=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
下列两种物质间发生反应,消耗等物质的量的酸,产生气体最多的是
A.木炭与浓硝酸B.铜与稀硝酸 C.锌与稀硫酸 D.木炭与浓硫酸
查看答案和解析>>
科目:高中化学 来源:2013-2014山东省潍坊市下学期期中考试高一化学试卷(解析版) 题型:选择题
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合
物,根据下列四种金属的熔沸点:
| Na | Cu | Al | Fe |
熔点 | 97.5.C | 1083℃ | 660℃ | 1535℃ |
沸点 | 883℃ | 2595℃ | 2200℃ | 3000℃ |
其中不能形成合金的是
A.Cu和Na B.Fe与Cu C.Cu与Al D.Al与Na
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com