
| A、强碱性溶液中:K+、Al3+、Cl-、SO42- |
| B、强酸性溶液中:Na+、S2-、K+、MnO4- |
| C、c(H+)=1×10-13mol/L溶液中:Na+、K+、Cl-、NO2- |
| D、室温下,pH=1的溶液中:K+、Fe3+、NO3-、SiO32- |


科目:高中化学 来源: 题型:
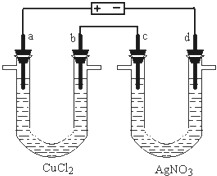 如图是一套电解装置,两U型管中均盛有50.0mL电解质溶液,a、b、c、d为 Pt电极.通电一段时间,d电极上析出金属Ag 2.16g,没有气体产生.同时在b、c两极收集到标准状况下相同体积的气体.请回答:
如图是一套电解装置,两U型管中均盛有50.0mL电解质溶液,a、b、c、d为 Pt电极.通电一段时间,d电极上析出金属Ag 2.16g,没有气体产生.同时在b、c两极收集到标准状况下相同体积的气体.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知甲醇在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为
(1)已知甲醇在常温下为液体,其热值为22.7kJ?g-1,则甲醇的标准燃烧热的热化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.4g NH3中含有N-H键数为0.2NA |
| B、0.5mol/L的CuCl2溶液中含Cl-数为NA |
| C、7.8g Na2S与7.8g Na2O2中含有的阴离子数目均为0.1NA |
| D、27g Al在22.4L Cl2(标况下)中燃烧,转移的电子总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中一定含有SO42- |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液.再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红, 下层溶液紫红色 实验现象2: 上层溶液变红 |
氧化性:Br2>Fe3+>I2 |
| C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| D | BaSO4固体加入饱和Na2CO3溶液中,过滤,向滤渣中加入盐酸 | 有气体生成 | Ksp(BaCO3)<Ksp(BaSO4) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24L CO2中含有的原子数为0.3NA |
| B、0.1mol F-中含有的电子数等于0.9NA |
| C、5.6g铁粉与氯气反应失去的电子数为0.2NA |
| D、电解饱和食盐水若产生2g氢气,则转移的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离常数 | Ka1 | Ka2 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
| H2S | 5.7×10-8 | 1.2×10-15 |
| A、NaHCO3+NaHS=Na2CO3+H2S反应可能发生 |
| B、H2S+Na2CO3=NaHS+NaHCO3反应不可能发生 |
| C、将Na2S溶液适当加热(忽略水的蒸发),溶液中阴离子数目会增多 |
| D、Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢: Mg>Al>Fe | 反应物的性质越活泼, 反应速率越快. |
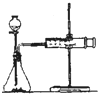 (1)该同学的实验目的是
(1)该同学的实验目的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com