
���� ��1����������ʽ�������ɵ�Ũ�ȱ仯����ƽ��ʱ����ɵ�Ũ�ȣ�����v=$\frac{��c}{��t}$����v��O2����
��2��ƽ�ⳣ��ֻ���¶�Ӱ�죬ƽ�ⳣ������Ӧ�ı��¶�ʹƽ��������Ӧ�����ƶ�������¶ȶ�ƽ���Ӱ�켰��Ӧ�����жϣ�
��3������Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�Ȳ��ٸı䣬�ɴ�������һЩ������Ҳ���䣬�Դ˽����жϣ�
��4��һ���¶��£���8mol SO2��4mol O2�������������������ܱ������У���t1ʱ��ﵽƽ�⣬��û�����������ʵ���Ϊ10mol����
2SO2��g��+O2��g��?2SO3��g�� ���ʵ�����С��n
2 1 2 1
4mol 2mol 4mol ��8mol+4mol��-10mol=2mol
ƽ��ʱ��SO2��O2��SO3�����ʵ����ֱ�Ϊ4mol��2mol��4mol��
���������ܱ������У�����һ�����ĺ�������Ӱ�췴Ӧ��������ֵ�Ũ�ȣ�ƽ�ⲻ�ƶ���
ƽ���ʹSO2��O2��SO3�������������1mol����ЧΪ����SO2��O2��SO3��������ֱ�Ϊ1mol��0.5mol��1mol������ѹǿ���ڵ���ƽ��Ļ������ڼ���0.5molO2���ݴ��жϣ�
��� �⣺��1����2min����ƽ�⣬��ʱ���SO3Ũ��Ϊ0.8mol•L-1����
2SO2��g��+O2��g��?2SO3��g��
��ʼ��mol/L����1 0.5 0
�仯��mol/L����0.8 0.4 0.8
ƽ�⣨mol/L����0.2 0.1 0.8
��v��O2��=$\frac{0.4mol/L}{2min}$=0.2mol•L-1•min-1��
�ʴ�Ϊ��0.2mol•L-1•min-1��
��2��ƽ�ⳣ��ֻ���¶�Ӱ�죬ƽ�ⳣ������Ӧ�ı��¶�ʹƽ��������Ӧ�����ƶ����÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ����Ӧ�����¶ȣ�
�ʴ�Ϊ��B��
��3��A��������������������ʼ���ʵ���֮��Ϊ2��1�����ڻ�ѧ������֮�ȣ���Ӧ������SO2��ת���ʺ�O2��ת����ʼ����ȣ�����˵������ƽ�⣬��A����
B�����º����£��淴Ӧ���У������ڷ�Ӧ�����������ʵ�����Сѹǿ���ͣ���������ѹǿ���ֲ��䣬˵������ƽ�⣬��B��ȷ��
C��v��SO2����=2v��O2���� �����������֮�ȵ��ڻ�ѧ������֮�ȣ���Ӧ����ƽ�⣬��C��ȷ��
D�������������������䣬�������ݻ����䣬�������ܶ�ʼ�ձ��ֲ��䣬�ܶȲ��䲻��˵������ƽ�⣬��D����
�ʴ�Ϊ��BC��
��4��һ���¶��£���8mol SO2��4mol O2�������������������ܱ������У���t1ʱ��ﵽƽ�⣬��û�����������ʵ���Ϊ10mol����
2SO2��g��+O2��g��?2SO3��g�� ���ʵ�����С��n
2 1 2 1
4mol 2mol 4mol ��8mol+4mol��-10mol=2mol
ƽ��ʱ��SO2��O2��SO3�����ʵ����ֱ�Ϊ4mol��2mol��4mol��
���������ܱ������У�����һ�����ĺ�������Ӱ�췴Ӧ��������ֵ�Ũ�ȣ�ƽ�ⲻ�ƶ���SO3��g�������ʵ������䣻
ƽ���ʹSO2��O2��SO3�������������1mol����ЧΪ����SO2��O2��SO3��������ֱ�Ϊ1mol��0.5mol��1mol������ѹǿ��ƽ��������Ӧ�����ƶ����ڵ���ƽ��Ļ������ڼ���0.5molO2��ƽ����������Ӧ�����ƶ���ƽ�������ƶ���
�ʴ�Ϊ�����䣻�����ƶ���
���� ���⿼�黯ѧƽ����йؼ��㡢��ѧƽ�ⳣ���뷴Ӧ���ʵļ��㡢��ѧƽ��״̬�жϵȣ��Ѷ��еȣ���4����ƽ���ƶ��жϹ���ƽ�⽨����;���ǹؼ�����������ƽ�ⳣ����Ũ���̽����жϣ����ȽϷ�����


 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
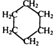 ���ü���ʽ��ʾΪ
���ü���ʽ��ʾΪ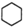 ��
��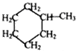 ���ü���ʽ��ʾΪ
���ü���ʽ��ʾΪ ��
��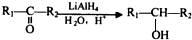 ��
��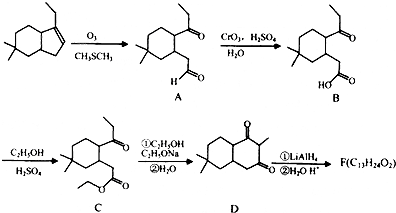
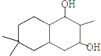 ��
��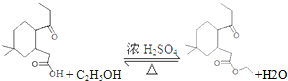 ��
��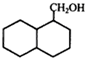 �ṹ
�ṹ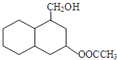 ��
��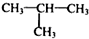 ��
��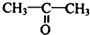 ������ͼ��ע����Ӧ������
������ͼ��ע����Ӧ�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������SO2��ˮ��Ӧ�IJ�������� | |
| B�� | SO2����ˮ�����ҷ�Ӧ���������� | |
| C�� | ���������Ư���ԣ��ܹ�ʹƷ����Һ��ɫ | |
| D�� | ������ȶ������ֽ�Ϊˮ��SO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | HCOOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� �� 25�棩 | Ki=1.77��10-4 | Ki=5.0��10-10 | Ki1=4.3��10-7 Ki2=5.6��10-11 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ca��ClO��2��aq��$\stackrel{CO_{2}}{��}$HClO��aq��$\stackrel{����}{��}$HCl��aq�� | |
| B�� | NaCl�����ͣ�$\stackrel{NH_{3}��CO_{2}}{��}$NaHCO3$\stackrel{��}{��}$Na2CO3 | |
| C�� | Al2O3$\stackrel{NaOH��aq��}{��}$NaAlO2��aq��$\stackrel{CO_{2}}{��}$Al��OH��3 | |
| D�� | NaAlO2��aq��$\stackrel{��������}{��}$AlCl3$\stackrel{���}{��}$Al |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
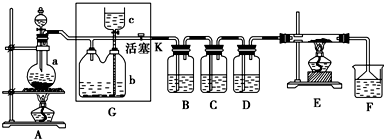
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pHֻ������ϡ��Һ������c��H+����1 mol/Lʱ��һ�㲻��pH��ֱ����H+��Ũ�ȱ�ʾ | |
| B�� | ˮ�ĵ��롢���ᡢ����ĵ��뼰����ˮ�ⶼ�����ȵ� | |
| C�� | pHÿ����һ����λ��c��H+�� �����10�� | |
| D�� | 25�洿ˮ�м��������pH��7����ʱˮ�����ӻ�����KW��1��10-14 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com