
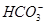 =CuCO3↓+CO2↑+H2O
=CuCO3↓+CO2↑+H2O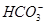 +H2O
+H2O H2CO3+OH-
H2CO3+OH-
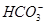
 H++
H++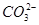 ,
,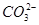 和Cu2+反应生成CuCO3沉淀,同时,H++
和Cu2+反应生成CuCO3沉淀,同时,H++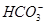
 H2CO3
H2CO3 H2O+CO2↑。
H2O+CO2↑。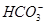 =CuCO3↓+CO2↑+H2O。
=CuCO3↓+CO2↑+H2O。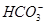 +H2O
+H2O H2CO3+OH-,Cu2+与OH-结合生成Cu(OH)2。
H2CO3+OH-,Cu2+与OH-结合生成Cu(OH)2。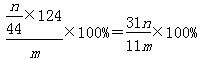


科目:高中化学 来源:不详 题型:填空题

| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 都看作
都看作 ,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的
,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的 和Mg2+可用一定浓度的Y溶液进行滴定,Y跟
和Mg2+可用一定浓度的Y溶液进行滴定,Y跟 都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验目的 | 操作或现象 |
| A | 检验碳与浓硫酸反应后的气体产物 | 将产生的气体依次通过无水CuSO4、澄清石灰水和品红溶液 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸钠溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热, 充分反应并冷却后,向溶液中加稀 HNO3酸化,再滴加AgNO3溶液 |
| D | 证明溶液中存在平衡:Fe3+ +3SCN-??Fe(SCN)3 | 将1 mL KSCN溶液与1 mL同浓度 FeCl3溶液充分混合;再继续加入KSCN 溶液,溶液颜色加深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.检验亚硫酸钠试样是否变质: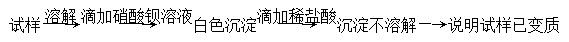 |
B.除去粗盐中含有的硫酸钙杂质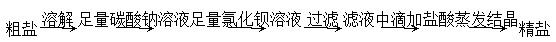 |
C.检验某溶液中是否含有Fe2+ |
| D.证明酸性条件H2O2的氧化性比I2强: |
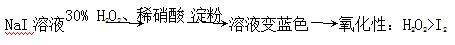
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
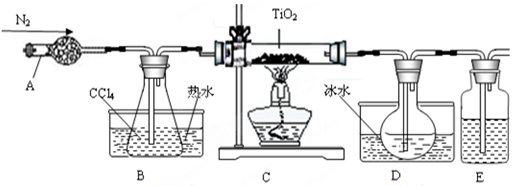
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
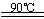 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)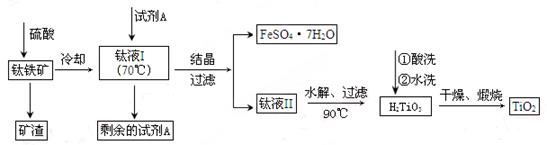
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 某钠盐W中加入稀硫酸,产生的无色无味的气体通入澄清石灰水 | 石灰水变浑浊 | W可能是Na2CO3 |
| B | 蘸有浓氨水的玻璃棒靠近溶液X | 有白烟产生 | X一定是浓盐酸 |
| C | 强酸性溶液Y中加入Ba(NO3)2溶液,静置后再加入KSCN溶液 | 先有白色沉淀, 后溶液又变红 | Y中一定含有SO42-和Fe3+ |
| D | 少量气态炔烃Z通入pH=a的溴水中 | 溴水褪色,溶液的pH仍约为a | Z与溴发生了取代反应 |
查看答案和解析>>
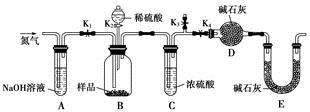
科目:高中化学 来源:不详 题型:单选题
| A.图甲所示,可得到干燥的氢气 |
| B.图乙所示,可以验证氯气的漂白性 |
| C.图丙所示,可以验证SO2的漂白性 |
| D.图丁所示,若石灰水变浑浊,证明混合气体中一定含有CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.84消毒液(NaClO溶液) |
| B.双氧水 |
| C.苯酚 |
| D.75%酒精 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com