
【题目】在一定的温度和压强下,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”。生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法错误的是
A. 二氧化碳与超临界水作用生成汽油的反应,属于放热反应
B. “水热反应”是一种复杂的化学变化
C. 火力发电厂可望利用废热,将二氧化碳转变为能源物质
D. 随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】现用Zn与实验室中的盐酸反应制取4.48L H2(标准状况)。
(1)如果选用所贴标签为2.0mol·L-1的盐酸,至少需该盐酸多少毫升?
(2)如果选用所贴标签为7%(密度为1.043g·mL-1)的盐酸,至少需该盐酸多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+I2(g) ![]() 2HI(g).已知起始时加入1molH2和2molI2(g),当达到平衡时H2的体积分数为φ.下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )
2HI(g).已知起始时加入1molH2和2molI2(g),当达到平衡时H2的体积分数为φ.下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )
A. 2molH2(g)和1molI2(g) B. 3molHI(g)
C. 2molH2(g)和2molI2(g) D. 1molI2(g)和2molHI(g)[来科
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融Na2CO3为电解质,H2和CO混合气为燃料的电池,原理如下图所示。下列说法正确的是
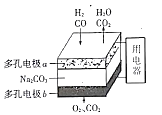
A. b是电池的负极
B. a电极的反应为:![]()
![]()
C. 电子由a电极经熔融Na2CO3向b电极移动
D. a、b两极消耗的气体的物质的量之比是1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q kJ |
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 平衡时,两容器中CO2的浓度相等
D. 容器①时CO的反应速率等于H2O的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种前20号元素,A比B的核电荷数少5个,B原子M层比L层电子少2个,则A、B分别是( )。
A.Li、NaB.Na、SC.Na、KD.K、Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种重要的化学材料。工业上利用含镍废料(镍、铁、 钙、镁合盒为主)制取草酸镍(NiC2O4).再高温煅烧草酸镍制取三氧化二镍。(已知草酸的钙、镁、镍盐均难溶干水。)工艺流程如图所示:
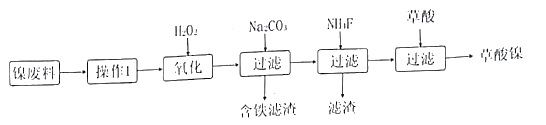
请回答下列问题:
(1)操作I为____。加入H2O2发生的主要反应的离子方程式为_____;加入碳酸钠溶液调节pH至4.0一5.0,其目的为______。
(2)若加入NH4F时滤液中c(Mg2+)=0.02 mol/L,设溶液体积不变,使滤液中Ca2+恰好沉淀完全,即溶液中c(Ca2+ )=1×10-5mol/L,判断此时是否有MgF2沉淀生成并加以解释:___。(已知CaF2、MgF2的Ksp分别为2.5×10-12、7.4×10-11)
(3)草酸镍高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为____。
(4)工业上还可用电解法制取N12O3,用NaOH溶液调节NiCl2溶液的pH至7.5,加入适量Na2SO4后用惰性电极电解。电解过程中产生的Cl2在弱碱性条件下生成ClO -,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为____。以Al和Ni2O3为电极,NaOH溶液为电解质溶液组成一种新型电池,放电时,Ni2O3转化为Ni(OH)2,该电池反应的化学方程式是____。
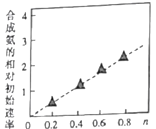
(5) Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图,由图可知Co2+、Ni2+两种离子中催化效果更好的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位,请据图回答下列问题:
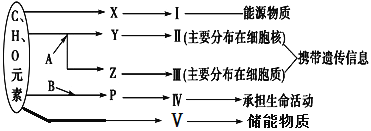
(1)图中A代表的元素是(用元素符号填写)_______________。图中X是_______________,Ⅰ在小麦种子中主要是指_______________。
(2)Ⅴ在动物、植物细胞均含有,是生物体内理想的储能物质,则Ⅴ是_______________。
(3)物质P是_______________,其结构通式为______________________________;若Ⅳ分子由n个P分子(平均相对分子质量为m)组成的2条链组成,则该Ⅳ分子的相对分子质量大约为______________。从理论上分析,该Ⅳ物质至少有_____个氨基和_____个羧基。
(4)生物体中的Ⅱ、Ⅲ的基本组成单位是__________各单位间是通过______________键连接起来的,可以通过___________________________对细胞进行染色,染色后Ⅱ呈现出_______色,Ⅲ呈现出_______色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HNO2的电离平衡常数为K=4.6×10-4(已知![]() =2.14),向20 mL 0.01 mol·L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
=2.14),向20 mL 0.01 mol·L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
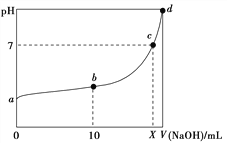
A. HNO2的电离方程式为HNO2===NO![]() +H+
+H+
B. a点H2O电离出的c(H+)=2.14×10-3 mol·L-1
C. b点溶液中离子浓度大小关系为c(NO![]() )>c(Na+)>c(H+)>c(OH-)
)>c(Na+)>c(H+)>c(OH-)
D. X值等于20
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com