
 向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
向50mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10mL,将其稀释至100mL,并向此稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )| A、产生的CO2体积(标准状况下)为0.056L |
| B、原NaOH溶液的物质的量浓度为0.5mol?L-1 |
| C、OA段所发生反应的离子方程式:H++OH-═H2O;CO32-+H+═HCO3- |
| D、NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1:1 |
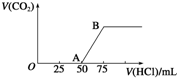 可知,生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为50mL-25mL=25mL,根据反应消耗盐酸的体积计算NaOH、Na2CO3的物质的量之比,以此来解答.
可知,生成CO2气体至最大,消耗HCl为25mL,若二氧化碳与NaOH反应后溶液中不含NaHCO3,由Na2CO3+HCl=NaHCO3+NaCl可知,将CO32-转化为HCO3-应消耗HCl为25mL,而图象中开始生成CO2气体时消耗HCl体积为50mL,说明该阶段还发生反应NaOH+HCl=NaCl+H2O,溶液中溶质为NaOH、Na2CO3,中和NaOH消耗HCl的体积为50mL-25mL=25mL,根据反应消耗盐酸的体积计算NaOH、Na2CO3的物质的量之比,以此来解答.| 0.0075mol |
| 0.01L |


科目:高中化学 来源: 题型:
| A、常温常压下,0.1mol 2H216O中含中子数、质子数、电子数均为NA |
| B、比黄金还贵的18O2和普通的16O2是两种不同的核素 |
| C、标准状况下,2.24L Cl2溶于水,转移的电子数目为0.1NA |
| D、1L 2mol?L-1的Al(NO3)3溶液中含Al3+个数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、原来盐酸的物质的量浓度为0.1 mol?L-1 |
| B、Y处溶液中只有两种离子 |
| C、原NaOH溶液的物质的量浓度为1 mol?L-1 |
| D、水的电离程度:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH═BaSO4↓+H2O |
| B、由水电离的c(H+)为10-3mol?L-1的溶液中,Na+、NO3-、SO32-、Cl-一定能大量共存 |
| C、向含有1mol KAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol |
| D、可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以汪明H2O2具有还原性2MnO4+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4mol/L |
| B、0.3mol/L |
| C、0.2mol/L |
| D、0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、推进以防治PM2.5为重点的大气污染防治工作 |
| B、积极推广风能、太阳能、氢能等新型能源的使用 |
| C、将生活垃圾、废品分类,实现资源再循环 |
| D、将高能耗、高污染的企业迁至偏僻的农村地区,提高当地居民收入 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaClO3中Cl的化合价是+5 |
| B、被氧化的Cl原子和被还原的Cl原子的物质的量的比为1:5 |
| C、Cl2既是氧化剂又是还原剂 |
| D、每生成1mol的NaClO3转移6mol的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ①B2H4 |
| ②H2O2/OH |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com