
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入适量苯,振荡、静置后 现象:CCl4层呈橙红色. | 假设1正确 |
| ②向溶液中加入KSCN溶液溶液 现象:溶液变为红色. | 假设2正确 |
分析 I.(1)配制FeBr2溶液时需要天平、钥匙、烧杯、玻璃棒、100ml的容量瓶,胶头滴管;
(2)a.洗涤溶解FeBr2的烧杯和玻璃棒,并将洗涤液转移至容量瓶中,保证溶质全部转移到容量瓶;
b.容量瓶不能作为溶解、储存溶液的仪器;
c.用电子天平称量质量为应为0.1×0.1×216=2.16g;
d.容量瓶不能储存溶液;
e.定容时,仰视容量瓶刻度线会使溶液体积增大;
f.容量瓶查漏后没有干燥就进行配制,结果无影响;
II.(3)假设1:Br-被C12氧化成Br2溶解在溶液中,通过溶液中加入适量四氯化碳,萃取出溴单质从而使CCl4层呈橙红色来证明有溴单质生成;假设2:Fe2+被C12氧化成Fe3+,向该溶液中加入KSCN溶液,溶液变为红色证明有三价铁生成;
(4)由还原性Fe2+>Br-,则氯化亚铁溶液中加入1~2滴溴水发生氧化还原反应生成Fe3+,反应为2Fe2++Br2=2Fe3++2Br-;
(5)还原性Fe2+>Br-,二者以1:1反应,由电子守恒可知,亚铁离子全部被氧化,溴离子一半被氧化;
解答 解:(1)配制FeBr2溶液时需要天平、钥匙、烧杯、玻璃棒、100ml的容量瓶,胶头滴管,则除烧杯、玻璃棒、量筒、外还需的玻璃仪器是胶头滴管、100ml的容量瓶,
故答案为:胶头滴管、100ml的容量瓶;
(2)a.洗涤溶解FeBr2的烧杯和玻璃棒,并将洗涤液转移至容量瓶中,保证溶质全部转移到容量瓶,故a正确;
b.容量瓶不能作为溶解、储存溶液的仪器,将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解是错误操作,故b错误;
c.用电子天平称量质量为应为0.1×0.1×216=2.16g,托盘天平只能称量到0.1g,故c错误;
d.容量瓶不能储存溶液,配制号的溶液应转移到试剂瓶中存放,故d错误;
e.定容时,仰视容量瓶刻度线会使溶液体积增大,测定结果偏低,故e正确;
f.容量瓶查漏后没有干燥就进行配制,水对测定结果无影响,故f正确;
故选aef,
故答案为:aef;
II.(3)假设1:Br-被C12氧化成Br2溶解在溶液中,通过溶液中加入适量四氯化碳,萃取出溴单质从而使CCl4层呈橙红色来证明有溴单质生成;假设2:Fe2+被C12氧化成Fe3+,向该溶液中加入KSCN溶液,溶液变为红色证明有三价铁生成;
故答案为:
| 实验步骤、预期现象 | 结论 |
| CCl4层呈橙红色 | |
| KSCN溶液,溶液变为红色 |
点评 本题考查氧化还原反应及氧化性、还原性的比较、实验设计,学生应注意物质的性质及氧化还原反应中电子守恒来分析,题目难度中等.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 加成反应 | B. | 酯化反应 | C. | 置换反应 | D. | 取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
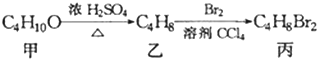 ,丙的结构简式不可能是( )
,丙的结构简式不可能是( )| A. | CH3CH(CH2Br)2 | B. | (CH3)2CBrCH2Br | C. | C2H5CHBrCH2Br | D. | CH3(CHBr)2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4g 铜与S完全反应,电子转移0.1 NA个 | |
| B. | 标准状况下,2.24 L水中含有0.1 NA个水分子 | |
| C. | 1.12 L氯气中含有0.1 NA个氯原子 | |
| D. | 0.1molNa2O2与足量的CO2反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al原子最外层电子数依次增多,其简单离子的氧化性依次增强 | |
| B. | P、S、Cl最高正化合价依次升高 | |
| C. | C、N、O原子半径依次增大 | |
| D. | Na、K、Rb氧化物的水化物碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有甲烷 | B. | 一定是甲烷和乙烯 | ||
| C. | 一定没有丙炔 | D. | 一定有乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
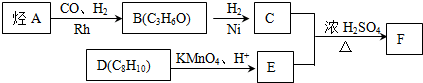

 .
.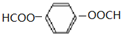 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com