
Ⅰ、已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反
应的体系中共有KCl.Cl2.H2SO4.H2O.KMnO4.MnSO4.K2SO4七种物质:
(1)该反应中,化合价升高的反应物是 。
(2)写出一个包含上述七种物质的氧化还原反应方程式:
(3)上述反应中,氧化剂是 ,1 mol氧化剂在反应中得到 mol电子。
Ⅱ、某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数测定
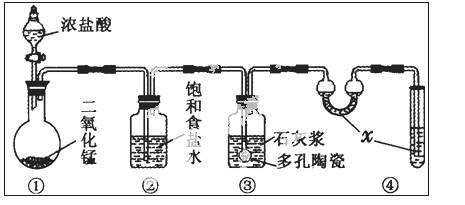
(1)装置④中的x试剂为 。
(2)装置③中发生反应的化学方程式为 。该反应是放热反应,反应温度较高时有副反应发生。改进该实验装置以减少副反应发生的方法是 _______________。
(3)测定漂白粉有效成分的质量分数
称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+ I- = 3Cl-+ IO3- IO3- + 5I- + 3H2O = 6OH- + 3I2
实验测得数据如下表所示。
| 滴定次数 | 1 | 2 | 3 |
| KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为 。若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,则测定结果将 (填“偏高”、“偏低”或“无影响”)
科目:高中化学 来源: 题型:
物质的量之比为2∶5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
A.1∶4 B.1∶5
C.2∶3 D.2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
在Cu+2H2SO4(浓)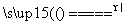 CuSO4+SO2↑+2H2O反应中:
CuSO4+SO2↑+2H2O反应中:
(1)________元素被氧化,________是氧化剂。
(2)用双线桥法标出该反应中电子转移的方向和数目。
Cu+2H2SO4(浓)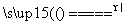 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(3)某一反应中有反应物和生成物的粒子共6种:SO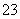 、I2、H+、SO
、I2、H+、SO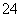 、I-、H2O,已知该反应中I2只发生如下过程:I2→I-,请回答:
、I-、H2O,已知该反应中I2只发生如下过程:I2→I-,请回答:
①该反应的还原剂是________(填分子或离子符号)。
②反应过程中,每有1molI2发生反应,转移的电子为____mol。
③写出该反应的离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述中,不正确的是( )
A.淀粉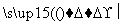 葡萄糖
葡萄糖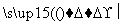 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B.纤维素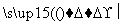 葡萄糖
葡萄糖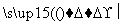 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C.油脂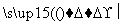 甘油和高级脂肪酸
甘油和高级脂肪酸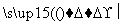 CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D.蛋白质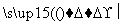 氨基酸
氨基酸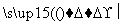 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A化学式为CxHyOz,15 g A完全燃烧可生成22 g CO2和9 g H2O。试求:
(1)该有机物的最简式____________________。
(2)若A的相对分子质量为60且和Na2CO3混合有气体放出,A和醇能发生酯化反应,则A的结构简式为:_____________________。
(3)若A分子结构中含有6个碳原子,具有多元醇和醛的性质,则其结构简式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
制备氮化镁的装置示意图如下:
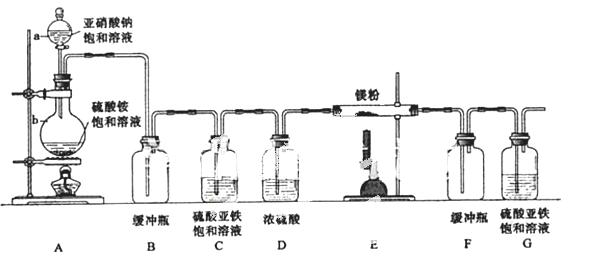
回答下列问题:
(1)检查装置气密性的方法是 ,
a的名称是 ,b的名称是 ;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式 ;
(3)C的作用是 ,D的作用是 ,是否可以把C和D的位置对调并说明理由 ;
(4)写出E中发生反应的化学方程式 ;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现
象 。
查看答案和解析>>
科目:高中化学 来源: 题型:
若溶液中由水电离产生的c(OH﹣)=1×10﹣14mol•L﹣1,满足此条件的溶液中一定可以大量共存的离子组是( )
|
| A. | Al3+ Na+NO3﹣ Cl﹣ | B. | K+ Na+Cl﹣ NO3﹣ |
|
| C. | K+ Na+ Cl﹣AlO2﹣ | D. | K+ NH4+ SO42﹣NO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
存在于茶叶的有机物A,其分子中所含的苯环上有2个取代基,取代基不含支链,且苯环上的一氯代物只有2种.A遇FeCl3溶液发生显色反应.F分子中除了2个苯环外,还有一个六元环.它们的转化关系如下:
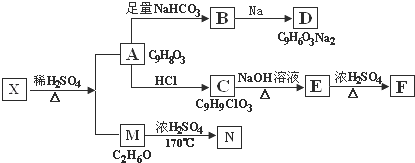
请回答下列问题:
(1)有机物A中含氧官能团的名称是 ;
(2)写出下列反应的化学方程式
A→B: ; M→N: ;
(3)A→C的反应类型为 ,E→F的反应类型为 ;
(4)1mol A可以和 mol Br2反应;
(5)某营养物质的主要成分(分子式为C16H14O3)是由A和一种芳香醇R发生酯化反应生成的,则R的含有苯环的同分异构体有 种(不包括R);
(6)A→C的过程中还可能有另一种产物C1,请写出C1在NaOH水溶液中反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
F1 F2 F3 G4 H3【2014·宁夏银川一中三模】(14分)
运用化学反应原理知识回答下列有关碳和碳的化合物的问题:
(1)汽车尾气的主要污染物是NO以及燃料燃烧不完全所产生的CO,它们是现代化城市的重要大气污染物,为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | NO | CO | E | F |
| 初始 | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
①请结合上表数据,写出NO与CO反应的化学方程式 .
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2,根据表中数据计算K1= 。根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)反应生成的气体E经常用氢氧化钠来吸收,现有0.4molE,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: .
(3)已知CH4、H2和CO的燃烧热分别为890.3kJ/mol,285.8 kJ/mol和283.0 kJ/mol,工业上利用天然气(主要成分是CH4)与CO2进行高温重整制备CO和H2,写出该反应的热化学方程式: .
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO为负极燃气,空气与CO2 的混合气为正极助燃气,制得在 650 ℃下工作的燃料电池,写出其负极和正极电极反应方程式:负极: ;正极: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com