
(10分). A 、B、 C、 D、 E是中学常见的5种化合物,A 、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。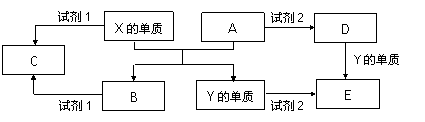
(1)X的单质与A反应的化学方程式是
(2)若试剂1和试剂2均是稀硫酸。
①如何验证D中的金属离子已全部转化为E:
②物质C溶于水有净水作用,原因是:
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠
为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是
(3)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:
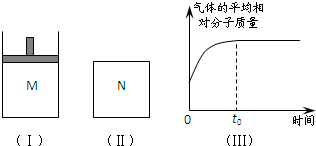 (2008?湖南模拟)如图Ⅰ,在恒压密闭容器M中加入2mol A和2mol B,起始时容器体积为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?)?x C(g);△H<0
(2008?湖南模拟)如图Ⅰ,在恒压密闭容器M中加入2mol A和2mol B,起始时容器体积为V L,发生如下反应并达到化学平衡状态:2A(?)+B(?)?x C(g);△H<0| 可能的情形 | A、B是否为气态 | z与y的大小关系 | M(B)与M(C)的大小关系 (M表示摩尔质量) | |
| A | B | |||
| ① | 是 | 不是 | z=y | 无法确定 |
| ② | 是 是 |
是 是 |
y>z y>z |
无法确定 无法确定 |
| ③ | 不是 不是 |
是 是 |
y>z y>z |
M(C)>M(B) M(C)>M(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
| a | 品红溶液 品红溶液 |
棉球变白,微热后又恢复红色 | 解释: SO2与品红反应生成无色不稳定物质,遇热分解又生成SO2和品红 SO2与品红反应生成无色不稳定物质,遇热分解又生成SO2和品红 结论:该气体具有漂白性. |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: SO2+OH-=HSO3- SO2+OH-=HSO3- |
| c | 淀粉和 碘 碘 的混合溶液 |
棉球变为白色 | 化学方程式: SO2+I2+2H2O=H2SO4+2HI SO2+I2+2H2O=H2SO4+2HI 结论:该气体具有 还原 还原 性. |
 (2)如图所示,将硬质玻璃管改装为燃烧管.挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).
(2)如图所示,将硬质玻璃管改装为燃烧管.挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).| 溶液A | 固体B | 气体C | |
| a. | 稀硫酸 | Zn | Cl2 |
| b. | 浓盐酸 | MnO2 | H2 |
| c. | 稀硝酸 | Fe | Cl2 |
| d. | 浓盐酸 | KMnO4 | H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com