
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
| 第三次 | 20.00 | 3.50 | 26.60 |
| c(酸)×V(酸) |
| V(碱) |
| c(酸)×V(酸) |
| V(碱) |
| c(酸)×V(酸) |
| V(碱) |
| c(酸)×V(酸) |
| V(碱) |
| c(酸)×V(酸) |
| V(碱) |
| 24.90mL+25.10mL |
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 21.98 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 22.02 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
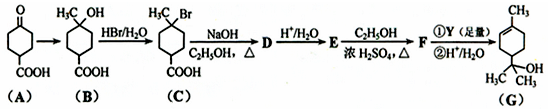
| ①R′MgBr(足量) |
| ②H+/H2O |
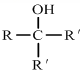
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1173K |
| 1220K~1420K |
| A、反应Ⅰ中的TiO2是氧化剂 |
| B、TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂 |
| C、a=b=c=2 |
| D、每生成9.6 g Ti,反应Ⅰ、Ⅱ中共转移0.8 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
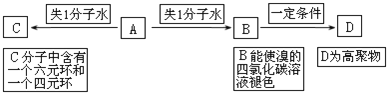
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0的溶液中:Na+、Fe2+、NO3-、ClO- | ||
| B、c(Fe3+)=0.1mol/L的溶液中:K+、Ba2+、SO42-、SCN- | ||
C、
| ||
| D、由水电离的c(H+)=1×10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com