
【题目】(1)①0.1 mol/L (NH4)2SO4溶液中各种离子的浓度由大到小顺序为__________。
②用离子方程式表示NaHCO3溶液显碱性的原因:______________。实验室中配制FeCl3溶液时常加入________溶液以抑制其水解。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=____________mol/L,在pH=3的CH3COOH溶液中,水电离出的c(H+)=__________ mol/L。
(3)利用反应Cu + H2O2 + H2SO4 = CuSO4 + 2H2O设计一个原电池,回答下列问题:
①负极材料为____________;正极反应式为__________________________。
②反应过程中SO42-向_______极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了______克。
【答案】c(NH4+)>c(SO42-)>c(H+)>c(OH-) HCO3-+H2O![]() H2CO3+OH- 盐酸 10-3 10-11 Cu H2O2 + 2H+ +2e-= 2H2O 负 3.2
H2CO3+OH- 盐酸 10-3 10-11 Cu H2O2 + 2H+ +2e-= 2H2O 负 3.2
【解析】
(1)①硫酸铵为强酸弱碱盐,其水溶液呈酸性,故溶液中离子浓度从大到小的顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-);
②碳酸氢钠溶液呈碱性,其原因是碳酸氢根在水中发生的水解,水解方程式为HCO3-+H2O![]() H2CO3+OH-;Fe3+在水溶液中溶液发生水解,故配制溶液是应加入少量的盐酸抑制水解;
H2CO3+OH-;Fe3+在水溶液中溶液发生水解,故配制溶液是应加入少量的盐酸抑制水解;
(2)由于醋酸根发生水解,故溶液中c(OH-)=10-3mol/L,由于OH-由水电离而来,水电离出的H+的浓度为10-3mol/L;醋酸在水溶液中电离,抑制的水的电离,故水中c(OH-)=10-11mol/L,水电离出的H+浓度为10-11mol/L;
(3)①方程式中Cu失去电子变成Cu2+,在原电池中做负极,H2O2中O原子得电子变成H2O,故负极材料为Cu,正极反应式为H2O2 + 2H+ +2e-= 2H2O;
②反应过程中负极有大量阳离子生成,需要阴离子平衡电荷,故溶液中硫酸根向负极移动;
③当电路中转移0.1mol电子,负极减少3.2g,同时总反应未生成气体、沉淀等物质,故电解质溶液质量增加3.2g。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
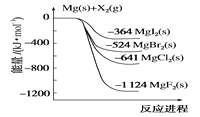
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.金属镁和卤素单质(X2)的反应都是放热反应
D.由图可知,此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为MgBr2(s)+Cl2(g)→MgCl2(s)+Br2(g)-117kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是( )

A.甲:可用Zn电极代替Cu电极作正极
B.乙:通入氧气的一极为正极
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:原电池Pb+PbO2+2H2SO4=2PbSO4+2H2O中,PbO2发生还原反应作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是( )

A.H2O的分解反应是放热反应
B.氢能源已被普遍使用
C.氢气不易贮存和运输,无开发利用价值
D.2 mol H2O具有的总能量低于2 mol H2和1 mol O2具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了锂离子电池开发的三位科学家。一种锂离子电池的结构如图所示,电池反应式为 LixC6 + Li1-xCoO2![]() C6 + LiCoO2(x<1)。下列说法正确的是
C6 + LiCoO2(x<1)。下列说法正确的是
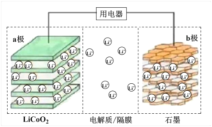
A.放电时,a极为负极
B.充电时,Li1-xCoO2/LiCoO2电极发生Li+脱嵌,放电时发生Li+嵌入
C.放电时,若转移0.02mol电子,石墨电极将减重0.21g
D.放电时,Li+在电解质中由a极向b极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1 mol共价键所需要吸收的能量分别为H—H:436 kJ,I—I:151 kJ,H—I:299 kJ,下列对H2(g)+I2(g)![]() 2HI(g)的反应类型判断错误的是( )
2HI(g)的反应类型判断错误的是( )
A.放出能量的反应B.吸收能量的反应
C.氧化还原反应D.可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
Ⅰ.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如图所示。
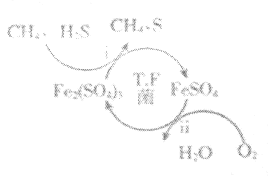
(1)过程i中H2S发生了___(填“氧化”或“还原”)反应。
(2)过程ii的离子方程式是___。
(3)已知:①Fe3+在pH=1.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
pH | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.4 | 2.7 | 3.0 |
Fe2+氧化速率/(g·L-1·h-1) | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 | 6.2 | 5.6 |
请结合以上信息,判断工业脱硫应选择的最佳pH范围,并说明原因:___。
II.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。
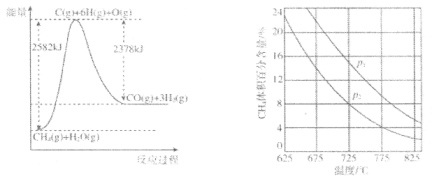
(4)①该过程的热化学方程式是___。
②比较压强p1和p2的大小关系:p1___p2(选填“>”“<”或“=”)。
III.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
IV.H2提纯:将CO2和H2分离得到H2的过程示意图如图。
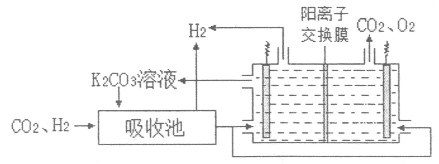
(5)①吸收池中发生反应的离子方程式是___。
②结合电极反应式,简述K2CO3溶液的再生原理:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质只含C. H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表化学键:单键、双键等)。
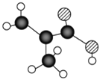
(1)该物质的结构简式为_________;
(2)该物质中所含官能团的名称为_________、_________;
(3)下列物质中,与该产品互为同分异构体的是______(填序号);与该产品互为同系物的是(填序号)________;
①CH3CH═CHCOOH ②CH2═CHCOOCH3 ③CH3CH2CH═CHCOOH ④CH3CH(CH3)COOH.
(4)下列对该物质性质的说法中,不正确的是_________。
A.它能使酸性高锰酸钾褪色 B.它能发生加成反应 C.它能发生酯化反应 D.它能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
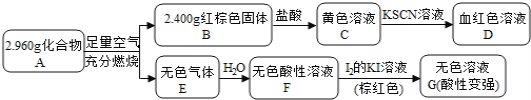
已知E是形成酸雨的主要气体,请回答:
(1)A的组成元素为______(用化学符号表示);
(2)C溶液可溶解铜片,写出该反应的离子方程式______________________________;
(3)写出F→G反应的化学方程式_________________________________,设计实验证明溶液G中含有![]() ____________________________________________________________________。
____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com