
| A. | 向BaCl2溶液中加入足量Na2CO3溶液后,静置,向上层清澈中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀 | |
| B. | 淀粉在稀硫酸的作用下水解后,加NaOH溶液使溶液呈碱性,加入新制Cu(OH)2,加热,若有砖红色沉淀生成,说明淀粉已经完全水解 | |
| C. | 将NaSO4•10H2O晶体置于坩埚内加热,称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水 | |
| D. | 用酸式滴定管向滴有酚酞的NaOH溶液中滴加HCl溶液,若滴入最后一滴HCl溶液后红色刚好褪去,且30s内颜色不复原,说明NaOH已完全中和 |
分析 A.沉淀完全的检验方法为:取少量上层清液于小试管中,滴加沉淀剂,若不再有沉淀产生,则沉淀完全;若还有沉淀生成,则不完全;
B.淀粉在稀硫酸的作用下水解后,只要淀粉水解,就有葡萄糖生成,在碱性条件下,能和氢氧化铜反应;
C.相邻两次称量的结果相同,说明固体已经恒重,说明硫酸钠已全部失去结晶水;
D.滴有酚酞的NaOH溶液呈粉红色,当滴入最后一滴HCl溶液后粉红色刚好褪去,且半分钟内不变色,说明碱已全部反应完.
解答 解:A.向BaCl2溶液中加入适量Na2CO3溶液后,发生反应:BaCl2 +Na2CO3 =BaCO3↓+2NaCl,取少量上层清液于小试管中,滴加Na2CO3,若不再有沉淀产生,则沉淀完全;若还有沉淀生成,则不完全,故A正确;
B.淀粉在稀硫酸的作用下水解后,只要淀粉水解,就有葡萄糖生成,淀粉在稀硫酸的作用下水解后,加入NaOH使溶液呈碱性,加入新制Cu(OH)2后加热,若有砖红色沉淀生成,只能说明有淀粉水解,但不能说明淀粉不能完全水解,故B错误;
C.将Na2SO4•10H2O晶体置于坩埚中加热,冷却后称量,并重复上述操作,若相邻两次称量的结果相同,说明固体已经恒重,说明硫酸钠已全部失去结晶水,故C正确;
D.滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,滴有酚酞的NaOH溶液呈粉红色,当滴入最后一滴HCl溶液后粉红色刚好褪去,且半分钟内不变色,说明碱已全部反应完,故D正确;
故选B.
点评 本题考查了化学实验方案的设计与评价,题目难度中等,明确难溶物溶解平衡及其影响、中和滴定操作方法、结晶水测定方法为解答关键,注意掌握化学实验方案设计与评价的原则,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 用Na2CO3溶液处理水垢中的不溶物:CaSO4(s)+CO${\;}_{3}^{2-}$(aq)=CaCO3(s)+SO${\;}_{4}^{2-}$ | |
| B. | 将Na2S溶液在空气中长期放置变浑浊:2S2-+O2+4H+=2S+2H2O | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO${\;}_{3}^{-}$+Ca2++2OH-=CaCO3↓+2H2O | |
| D. | 向Fe(NO3)3溶液中通入过量SO2:2Fe3++SO2+2H2O=2Fe2++SO${\;}_{4}^{2-}$+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
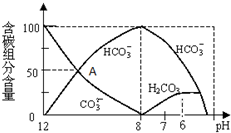
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往溶液中加入适量的氢氧化钠,使溶液中c(Na+)=c(CH3 COO-) | |
| B. | 将溶液与10 mLpH=10的NaOH溶液混合 | |
| C. | 将溶液与10 mL浓度为a mol•L-1的NaOH溶液混合 | |
| D. | 将溶液稀释到10 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
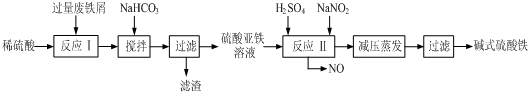
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com