
| 容器 编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.60 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正>ν逆 |
分析 (1)该反应为吸热反应,则升高温度化学平衡正向移动;
(2)根据反应可知C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1,△H>0,△S>0;
(3)将体系中的C (s)全部移走,则体系中只有逆反应;
(4)根据Ⅰ计算平衡常数,Ⅱ中处于平衡状态,根据平衡常数计算Ⅱ中c(H2);计算Ⅲ中此时的浓度商Qc,与平衡常数比较,判断反应进行的方向判断;
(5)由C (s)+H2O(g)?CO (g)+H2 (g)、2CO(g)+O2(g)=2CO2、2H2 (g)+O2 (g)=2H2O及盖斯定律来计算整个过程的焓变.
解答 解:(1)该反应正反应是吸热反应,升高温度平衡向正反应方向移动,平衡常数增大,
故答案为:增大;
(2)根据反应可知C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1,△H>0,反应生成的气体增大,混乱度增加,是一下熵增的过程,则△S>0,
故答案为:A;
(3)将体系中的C (s)全部移走,则体系中只有逆反应,则该化学平衡向左移,
故答案为:左移;
(4)由Ⅰ可知,平衡常数K=$\frac{0.1×0.6}{0.06}$=1,Ⅱ中处于平衡状态,根据平衡常数可知Ⅱ中c(H2)=$\frac{K×c({H}_{2}O)}{c(CO)}$=$\frac{1×0.12}{0.2}$mol/L=0.60mol/L,
Ⅲ中此时的浓度商Qc=$\frac{0.4×0.2}{0.1}$=0.8<1,故反应向正反应方向进行,故ν正>ν逆,
故答案为:0.60;>;
(5)①C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
②2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ•mo1-1
③2H2 (g)+O2 (g)=2H2O (g)△H=-483.6kJ•mo1-1
则将24g 炭完全转化为水煤气,然后再充分燃烧,三个反应均发生,①×2+②+③
由盖斯定律可知,①×2+②+③即整个过程的焓变为2mol×(+131.3kJ•mol-1)+(-566.0kJ•mol-1)+(-483.6kJ•mol-1)=-787.0kJ•mol-1,
故答案为:-787.0.
点评 本题考查化学平衡的移动、化学平衡的计算、反应热的计算等,有一定难度,特别是第(4)问学生要学会利用数据来分析解答.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:填空题
 已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH.
已知乙醇可以和氯化钙反应生成微溶于水的CaCl2•6C2H5OH.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
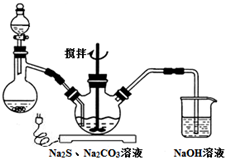 NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
NaCN为剧毒无机物.某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)=C(金刚石);△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ | |
| D. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铝溶于氢氧化钠溶液:Al+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| C. | 过氧化钠与水反应:Na2O2+2H2O═2Na++2OH-+O2↑ | |
| D. | FeCl2溶液跟Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com