
下列叙述正确的是( )
A.碳酸氢钠溶液可用于区分乙酸、乙醇和苯
B.糖类、油脂、蛋白质都是高分子化合物,都可以在一定条件下发生水解反应
C.用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度
D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性
A
【解析】
试题分析:A.碳酸氢钠溶液加入乙酸中发生反应冒气泡;加入乙醇中不发生反应,不分层;而加入苯中,不能相互溶解而出现分层现象。三种液体,现象个不相同,可以鉴别。正确。B.糖类、油脂、蛋白质都可以在一定条件下发生水解反应,但是只有蛋白质一定是高分子化合物,而糖类中的葡萄糖、蔗糖是小分子,油脂也不是高分子化合物。错误。C.用乙醇和浓硫酸制备乙烯时,要迅速加热至温度到170℃,水浴加热温度最高为100℃,因此不能用水浴加热控制反应的温度。错误。D.将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,前者是由于溶解度减小,后者是因为蛋白质变性,原因不同。
考点:考查物质的制备、鉴别及性质的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014学年广东省茂名市高三第二次高考模拟理综化学试卷(解析版) 题型:选择题
下列有关常见有机物说法正确的是
A.乙烯、苯、纤维素均属于烃类化合物
B.天然氨基酸能与强酸或强碱溶液反应
C.石油的蒸馏、裂化属于化学变化
D.油脂、聚氯乙烯均属于高分子化合物
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省深圳市高三第二次调研考试理综化学试卷(解析版) 题型:选择题
表中陈述I、II均正确,且两者在反应原理上相似的是( )
选项 | 陈述I | 陈述II |
A | 向酚酞溶液中加Na2O2,溶液先变红后褪色 | 向石蕊溶液中通入Cl2,溶液先变红后褪色 |
B | 将SO2和Cl2同时通入BaCl2溶液中,产生白色沉淀 | 将CO2和NH3同时通入CaCl2溶液中,产生白色沉淀 |
C | 向MgCl2溶液中加入NaOH溶液生成白色沉淀 | 向FeCl3溶液中加入NaOH溶液生成红褐色沉淀 |
D | Na投入水中产生大量气泡 | Na2CO3投入盐酸中产生大量气泡 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省惠州市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
北大和中科院已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子晶体,具有良好的超导性。有关分析正确的是
A.K3C60中只有离子键 B.K3C60中碳元素显-3价
C.该晶体在熔融状态下能导电 D.该晶体熔点较低
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市番禺区高考统考(一)理综化学试卷(解析版) 题型:选择题
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置(如图)就能实现相应实验目的是( )
选项 | A | B | C | D |
实验目的 | 从碘水中提取碘 | 用10mol?L-1盐酸配制100mL 0.1mol?L-1盐酸 | 用NaCl溶液制备氯化钠晶体 | 除去C2H4中少量SO2 |
实验仪器或装置 | 烧杯、分液漏斗 | 100mL容量瓶、量筒、玻璃棒、烧杯 |
|
|
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:填空题
苯乙烯是重要的基础有机原料。工业中用乙苯(C6 H5- CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5- CH= CH2)的反应方程式为:
C6 H5- CH2 CH3 (g) C6 H5- CH=CH2 (g) +H2(g) ΔH1
C6 H5- CH=CH2 (g) +H2(g) ΔH1
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:
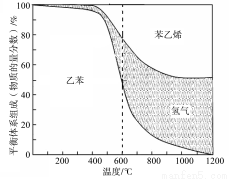
由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
① 氢气的物质的量分数为 ;乙苯的物质的量分数为 ;
② 乙苯的平衡转化率为 ;
③ 计算此温度下该反应的平衡常数(请写出计算过程)。
(2) 分析上述平衡体系组成与温度的关系图可知:△H1 0(填“>、=或<” )。
(3)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率 30%(填“>、=、<” )。
(4)已知:
3C2 H2 (g)  C6 H6 (g) ΔH2
C6 H6 (g) ΔH2
C6 H6 (g) + C2H4 (g)  C6 H5- CH2CH3 (g) ΔH3
C6 H5- CH2CH3 (g) ΔH3
则反应3C2H2 (g) + C2H4 (g)  C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和叙述Ⅱ均正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SiO2是酸性氧化物 | 用盐酸刻蚀石英制品 |
B | 氯化钠熔点很高 | 电解熔融氯化钠制备钠 |
C | 铝具有还原性 | 铝粉和氧化铁粉末可发生铝热反应 |
D | 硬铝是合金材料 | 硬铝在空气中生成致密氧化膜 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省枣庄市高三下学期第二次模拟考试理综化学试卷(解析版) 题型:填空题
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究.
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)= IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)  HOI(aq) △H2
HOI(aq) △H2
③HOI(aq) + I-(aq) + H+(aq)  I2(aq) + H2O(l) △H3
I2(aq) + H2O(l) △H3
总反应的化学方程式为__ ____,其反应△H=___ ___
(2)在溶液中存在化学平衡:I2(aq) + I-(aq)  I3-(aq),其平衡常数表达式为_______.
I3-(aq),其平衡常数表达式为_______.
(3)为探究Fe2+ 对O3氧化I-反应的影响(反应体如左图),某研究小组测定两组实验中I3-浓度和体系pH,结果见右图和下表。
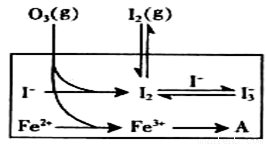

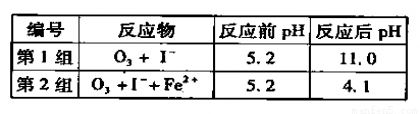
①第1组实验中,导致反应后pH升高的原因是_______。
②图13中的A为__ ___,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是 。
③第2组实验进行18s后,I3-浓度下降。导致下降的直接原因有(双选)______。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图14,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:填空题
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 ;W的电子式 。
(2)已知:①2E → E-E;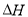 =-a kJ·mol-1 ② 2A → A-A;
=-a kJ·mol-1 ② 2A → A-A;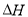 =-b kJ·mol-1
=-b kJ·mol-1
③E+A → A-E;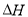 =-c kJ·mol-1
=-c kJ·mol-1
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);
X(g);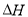 =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 |
|
|
|
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率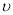 ( A2)为 。
( A2)为 。
②该温度下此反应的平衡常数K的值为 。
③下列现象能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A.内A2、BC、X的物质的量之比为2:1:1
B.内气体的密度保持恒定
C.内A2气体的体积分数保持恒定
D.2 V正(A2)=V逆(BC)
④三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=a C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在上图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com