

| ||
| 2 |
| 9.6g |
| 64g/mol |
| 0.2mol |
| 2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
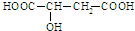 �������й�ƻ�����˵������ȷ���ǣ�������
�������й�ƻ�����˵������ȷ���ǣ�������| A��1molƻ�������������Ʒ�Ӧ����������3g |
| B��1molƻ��������������������Һ��Ӧ������3mol�������� |
| C��1molƻ��������������̼��������Һ��Ӧ�����������44.8L�Ķ�����̼���� |
| D��ƻ������һ�������¼�������ᷴӦ���������Ҵ���Ӧ��Ҳ������������������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO����mol�� | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����t��ʱ��ijNaOHϡ��Һ�У�c��H+��=10-amol/L��c��OH-��=10-bmol/L����֪a+b=12����
����t��ʱ��ijNaOHϡ��Һ�У�c��H+��=10-amol/L��c��OH-��=10-bmol/L����֪a+b=12�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
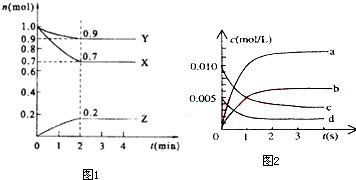
 ij���淴Ӧ��ij���Ϊ5L���ܱ������н��У��ڴ�0-3���Ӹ����ʵ����ı仯�����ͼ��ʾ��A��B��C��Ϊ���壩��
ij���淴Ӧ��ij���Ϊ5L���ܱ������н��У��ڴ�0-3���Ӹ����ʵ����ı仯�����ͼ��ʾ��A��B��C��Ϊ���壩���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
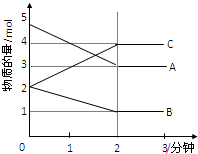
 �������������ЧӦ����Դ��ȱ����������ӣ����ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӣ�Ŀǰ��һ�ַ�������CO2������ȼ�ϼ״�CH3OH������������5L�ܱ������У�����һ������CO2�� H2��һ�������·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����������ӦΪ���ȷ�Ӧ������10min��Ӧ�ﵽƽ�⣬������ʵ�Ũ�����±���ʾ��
�������������ЧӦ����Դ��ȱ����������ӣ����ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӣ�Ŀǰ��һ�ַ�������CO2������ȼ�ϼ״�CH3OH������������5L�ܱ������У�����һ������CO2�� H2��һ�������·�����Ӧ��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����������ӦΪ���ȷ�Ӧ������10min��Ӧ�ﵽƽ�⣬������ʵ�Ũ�����±���ʾ��| �� �� | CO2 | H2 | CH3OH��g�� | H2O��g�� |
| ��ʼŨ�ȣ�mol/L�� | 1.0 | 3.0 | 0 | 0 |
| 10minĩŨ�ȣ�mol/L�� | 0.75 | 0.75 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
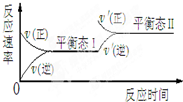
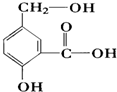 ��ij�л���A�ķ�����ṹ��ʽ��ͼ����ش�
��ij�л���A�ķ�����ṹ��ʽ��ͼ����ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���١��� | B���ڡ��� |
| C���ܡ��� | D���ܡ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com