
����Ŀ��������������Դ���������й㷺��;��������Ni���������缫���ŨNaOH��Һ�Ʊ���������Na2FeO4��װ����ͼ��ʾ�������ƶϺ��������� ��
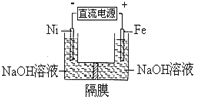
A. �����������缫��ӦΪFe��6e-+4H2O=FeO42-+ 8H+
B. ���ʱ���ӵ���������Ϊ��������Ni�缫����Һ��Fe�缫������
C. ����ĤΪ�����ӽ���Ĥ����OH-���������ƶ�
D. ���ʱ������pH���͡�������pH���ߣ���ȥ��Ĥ��Ϻ���ԭ��Һ�Ƚ�pH���ͣ�������ǰ������仯���Բ��ƣ�
���𰸡�D
�����������������A������װ��ͼ������֪�����Դ��������������������������Һ�������������ӣ��缫��ӦΪFe-6e-+8OH-�TFeO42-+4H2O����A����B���������е�����������Ni�缫������ͨ���������Һ����ͨ���������Һ�����Ӷ����ƶ�ʵ�ֱպϵ�·��ͨ��Fe�缫�ص���������B����C�������ӽ���Ĥֻ����������ͨ��������������������Ӧ���������ƶ�����C����D������������ʧ�����������������ӣ���ҺPH��С�������������ӵõ�����������������Һ������������Ũ��������ҺPH���������������������ʵ������ģ��������缫��ӦFe-6e-+8OH-�TFeO42-+4H2O�������������������缫��Ӧ2H++2e-=H2�������ݵ����غ�������������������ĵĶ࣬���ɵ��٣�������ҺpH���ͣ���D��ȷ����ѡD��


 ��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ��ټ��ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���������Һ��ͨ����Ӧ����������ҺpH=7��ͨ���������Һ�����Ӱ��ɺ��ԣ�����Һ�в����������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ� ��
A. ��0.10mol��L��1NH4HCO3��Һ��ͨ��CO2��c(NH4��)=c(HCO3��)��c(CO32��)
B. ��0.10mol��L��1NaHSO3��Һ��ͨ��NH3��c(Na��)>c(NH4��)>c(SO32��)
C. 0.10mol��L��1Na2SO3��Һͨ��SO2��c(Na��)=2[c(SO32��)��c(HSO3��)��c(H2SO3)]
D. 0.10mol��L��1CH3COONa��Һ��ͨ��HCl��c(Na��)>c(CH3COOH)=c(Cl��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ȷ��ʾ��ϩ�ṹ��ʽ����
A. C2H4 B. CH2 CH2 C. CH2 �� �� CH2 D. CH2= CH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ס�������������ͬ�������壬�ڿ�����ȼ�յõ����������������ʱ����P4O6����������ʱ����P4O10��
(1)��֪298 Kʱ���ס�������ȫȼ�յ��Ȼ�ѧ����ʽ�ֱ�Ϊ
P4(s������)��5O2(g)===P4O10(s) ��H1����2 983.2 kJ��mol��1
P(s������)��![]() O2(g)===
O2(g)===![]() P4O10(s) ��H2����738.5 kJ��mol��1
P4O10(s) ��H2����738.5 kJ��mol��1
����¶��°���ת��Ϊ�����Ȼ�ѧ����ʽΪ ��
(2)��֪298 Kʱ���ײ���ȫȼ�յ��Ȼ�ѧ����ʽΪP4(s������)��3O2(g)===P4O6(s) ��H����1638 kJ��mol��1����ij�ܱ������м���62 g����50.4 L����(��״��)����������ʹ֮ǡ����ȫ��Ӧ�������õ���P4O10��P4O6�����ʵ���֮��Ϊ ����Ӧ�����зų�������Ϊ ��
(3)��֪����PCl3�ķ��ӽṹ��ͼ�����ṩ���»�ѧ���ļ���(kJ��mol��1)��P��P 198��Cl��Cl 243��P��Cl 331��

��ӦP4(s������)��6Cl2(g)===4PCl3(s)�ķ�Ӧ�Ȧ�H�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��ɫ������Һ���ܴ��������һ��������
A. Na+��K+��HCO3-��NO3- B. Mg2+��SO42-��Al3+��NO3-
C. Na+��Ca2+�� NO3-��CO32- D. K+��MnO4-��CH3COO-��NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ����CO(g)+2H2(g) ![]() CH3OH(g)����H1
CH3OH(g)����H1
��Ӧ����CO2(g)+3H2(g) ![]() CH3OH(g)+ H2O(g)����H2
CH3OH(g)+ H2O(g)����H2
�±����������Ƿ�ӦI�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ��(K)��
�¶� | 250�� | 300�� | 350�� |
K | 2.0 | 0.27 | 0.012 |
��1����һ�������½�2 molCO��6molH2����2L���ܱ������з�����ӦI��5min����c(CO)=0.4 mol��L������˶�ʱ��ķ�Ӧ����(��H2��ʾ)___________ mol��(L��min)��
��2���ɱ��������ж���H1_____0(����>������<������=��)��Ӧ��C02(g)+H2(g)![]() CO(g)+H20(g) ��H3=____(����H1����H2��ʾ)��
CO(g)+H20(g) ��H3=____(����H1����H2��ʾ)��
��3���������ݻ����䣬���д�ʩ����߷�Ӧ����COת���ʵ���_________(ѡ��ĸ)��
a������CO��ʹ��ϵ��ѹǿ����
b����CH3OH(g)����ϵ�з���
e������He��ʹ��ϵ��ѹǿ����
d��ʹ�ø�Ч����
��4��д����Ӧ��Ļ�ѧƽ�ⳣ������ʽ��K=_________�����ֺ��º��ݵ������½���Ӧ���ƽ����ϵ������Ũ�Ⱦ�����һ������ѧƽ��_________(����������������������������)�ƶ���ƽ�ⳣ��K____(���������������С������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�뽺��������ص���
A. ���������ӵ������ͽ������̣��б�������
B. ��������˥�ߵȼ��������ѪҺ�ж���������ѪҺ����������
C. ˮ�೧��ұ���ø�ѹֱ�����ȥ�����̳������ٶԿ�������Ⱦ
D. ����������ˮ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ⶨ���������нᾧˮ����������Ҫ��������
A.��ͷ�ι�B.������C.����D.������ƽ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com