
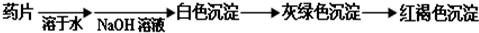
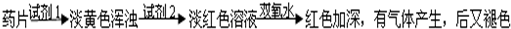


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:阅读理解
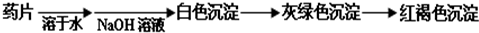
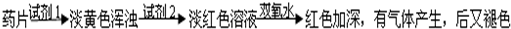
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ① |
| KSCN溶液 |
| 新制氯水 |
| 一段时间后 |
| 编号 | 猜想 |
| 假设1 | 新制的氯水具有漂白性,溶液被漂白 新制的氯水具有漂白性,溶液被漂白 |
| 假设2 | 溶液中的SCN-被过量的氯水氧化 |
| 假设3 | 溶液中的Fe3+被还原成Fe2+ 溶液中的Fe3+被还原成Fe2+ |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少量褪色后溶液,加入KSCN溶液 取少量褪色后溶液,加入KSCN溶液 |
如果溶液变红色,说明该同学的猜想是合理的;如果溶液不变红色,说明乙同学的猜想是不合理的 如果溶液变红色,说明该同学的猜想是合理的;如果溶液不变红色,说明乙同学的猜想是不合理的 |
| ② | 取少量褪色后溶液,加入FeCl3溶液 取少量褪色后溶液,加入FeCl3溶液 |
如果溶液仍不变红色,说明该同学的猜想是合理的;如果溶液变红色,说明该同学的猜想是不合理的 如果溶液仍不变红色,说明该同学的猜想是合理的;如果溶液变红色,说明该同学的猜想是不合理的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
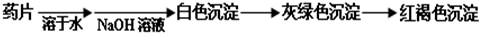
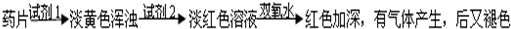
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省淄博市高一(上)期中化学试卷(解析版) 题型:填空题
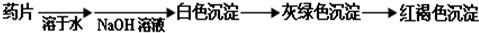
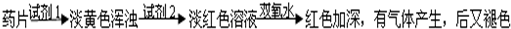
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com