
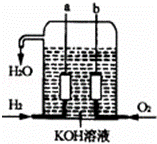
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
(1)①a极负极
②a电极反应式为
(2)氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制.常用的燃料,往往是某些碳氢化合物,如甲烷(天然气)、汽油等.请写出将图中H2换成CH4时所构成的甲烷燃料电池中 ①a极的电极反应式
②甲烷燃料电池总的离子反应方程式为 .
考点:原电池和电解池的工作原理.
分析:(1)氢氧燃料电池中,原电池工作时,氢氧燃料电池的总反应为2H2+O2=2H2O;通入氢气的一极a为电源的负极,发生氧化反应,电极反应式为:H2﹣2e﹣+2OH﹣=2H2O;
(2)氢气换成甲烷是甲烷和氧气反应生成二氧化碳和水的氧化还原反应,图中电解质溶液是碱性溶液,依据原电池的原理,结合元素化合价变化分析失电子的物质甲烷在负极a发生氧化反应,氧气再正极b发生还原反应.
解答: 解:(1)氢氧燃料电池中,通入氢气的一极为电源的负极,通入氧气的一极为原电池的正极,由于电解质溶液呈碱性,则负极电极反应式为:2H2﹣4e﹣+4OH﹣=4H2O;
故答案为:负;2H2﹣4e﹣+4OH﹣=4H2O;
(2)图中H2换成CH4时所构成的甲烷燃料电池中,甲烷燃烧生成二氧化碳和水,二氧化碳和氢氧化钾反应生成碳酸钾和水,所以电池的反应的离子方程式为:CH4+2O2+2OH﹣=CO32﹣+3H2O,正极上是氧气得到电子发生还原反应,电极反应式为:O2+2H2O+4e﹣=4OH﹣;电池总反应的离子方程式减去正极电极反应×2,得到负极电极反应:CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O;
故答案为:CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O、CH4+2O2+2OH﹣=CO32﹣+3H2O.
点评:本题考查了原电池的工作原理的应用,电极名称,电极判断,电极反应,电池反应,熟练掌握原电池的基本知识,分清化合价变化判断氧化反应、还原反应、电子守恒是解题关键.


科目:高中化学 来源: 题型:
某学生做乙醛还原性的实验,取1 mol·L-1的CuSO4溶液2 mL和0.4 mol·L-1的NaOH溶液4 mL,在一个试管内混合后加入0.5 mL 40%的乙醛溶液加热至沸腾,无砖红色沉淀,实验失败的原因是( )
A.NaOH不足量 B.CuSO4不足量
C.乙醛溶液太少 D.加热时间不够
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种常见药物①阿司匹林②青霉素③胃舒平④麻黄碱.请回答:
(1)某同学胃酸过多,应选用的药物是 (填序号).
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是 (填序号).
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是 (填序号).
(4)滥用药物会导致不良后果,如过量服用 (填序号)会出现水杨酸中毒,应立即停药,并静脉注射NaHCO3.
查看答案和解析>>
科目:高中化学 来源: 题型:
高温下,某反应达到平衡,平衡常数K=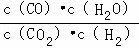 .恒容时,温度升高,H2浓度减小.下列说法正确的是( )
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,H2(g)+CO2(g)⇌H2O(g)+CO(g) 的平衡常数K=2.25.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示.下列判断不正确的是( )

A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
B.14g乙烯、丙烯的混合气体含有C﹣H数为2NA
C.标准状况下,4.48L重水(D2O)中含有的中子数为2NA
D.向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
若以w1和w2分别表示物质的量是浓度为c1 mol/L和c2 mol/L氨水溶液的质量分数,已知2w1=w2,则下列推断正确的是( )(已知氨水的密度小于纯水的密度)
A.2c1=c2 B.2c2=c1 C.c2>2c1 D.c1<c2<2c1
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3和AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后铁完全反应,且溶液中不存在Fe3+,同时又析出0.1mol Ag.则下列结论中不正确的是( )
A. 反应后溶液中Cu2+与Fe2+的物质的量之比为1:2
B. 氧化性:Ag+>Cu2+>Fe3+>Zn2+
C. 含Fe3+的溶液可腐蚀铜板
D. 1mol Fe可还原2mol Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,能达到实验目的的是
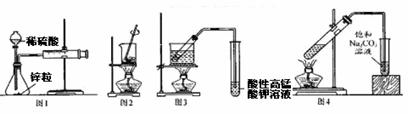
A.图1——测量锌与硫酸反应的速率
B.图2——灼烧海带成海带灰
C.图3——验证溴乙烷与NaOH乙醇溶液反应生成乙烯
D.图4——实验室制备收集乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com