
| A、氯化钾 | B、氢氧化钠 |
| C、硫酸 | D、水 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
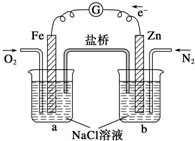
| A、烧杯a中的溶液pH降低 |
| B、烧杯b中发生氧化反应 |
| C、烧杯a中发生的反应为2H++2e-═H2 |
| D、烧杯b中发生的反应为2Cl--2e-═Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| A | 所有单质中密度最小 |
| B | 形成化合物种类最多的元素 |
| D | 基态原子中只有3个能级,有2个未成对电子 |
| E | 短周期中原子半径最大 |
| F | 第三周期中电负性最大的元素 |
| G | 最外层只有一个电子,内层填满电子 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 下表是元素周期表前三周期的一部分,按要求作答:
下表是元素周期表前三周期的一部分,按要求作答: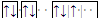

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅的分子式 SiO2 | ||
B、质子数为53,中子数为78的碘原子:
| ||
| C、2-甲基-1-丁醇的结构简式:(CH3)2CHCH2CH2OH | ||
D、次氯酸的电子式 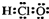 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.8g重水(D2O)中含有的质子数为1.0 NA |
| B、500℃、30MPa下:N2(g)+3H2(g)?2NH3(g);△H=-38.6kJ?mol-1;将1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3kJ |
| C、标准状况下,11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
| D、60 g石英晶体中含有的Si-O键数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com