
【题目】下列颜色变化与氧化还原反应无关的是( )
A.将乙醇滴入酸性K2Cr2O7溶液中,溶液由橙色变为绿色
B.将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去
C.将H2C2O4溶液滴入酸性KMnO4溶液中,溶液紫色褪去
D.将乙醛加入新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀
【答案】B
【解析】解:A.2K2Cr2O7+3C2H5OH+8H2SO4=2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,Cr2O72﹣转化为Cr3+ , C元素化合价由﹣2价变为0价,有电子转移,所以属于氧化还原反应,故A不选;B.2NaOH+SO2=Na2SO3+H2O,该反应中各元素化合价不变,没有电子转移,所以不属于氧化还原反应,故B选;
C.2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,所以有电子转移,属于氧化还原反应,故C不选;
D.CH3CHO+2Cu(OH)2 ![]() CH3COOH+Cu2O↓+2H2O,该反应中C元素化合价由﹣1价变为0价、Cu元素化合价由+2价变为+1价,所以有电子转移,属于氧化还原反应,故D不选;
CH3COOH+Cu2O↓+2H2O,该反应中C元素化合价由﹣1价变为0价、Cu元素化合价由+2价变为+1价,所以有电子转移,属于氧化还原反应,故D不选;
故选B.


科目:高中化学 来源: 题型:
【题目】近年来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素. 
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
①结合上表数据,写出NO与活性炭反应的化学方程式;
②上述反应的平衡常数表达式K= , 根据上述信息判断,T1和T2的关系是;
A.T1>T2 B.T1<T2 C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是;
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2 , 具体流程如图1所示
①用离子方程式表示反应器中发生的反应;
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是;
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示通过a气体的电极是原电池的极(填“正”或“负”),b电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 ![]() 苯酚具有弱酸性,其Ka=1.1×10﹣10;水杨酸第一级电离形成的
苯酚具有弱酸性,其Ka=1.1×10﹣10;水杨酸第一级电离形成的 ![]()
离子能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)Ka(苯酚)(填“>”或“<”),其原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在接触室里用98.3%的浓硫酸吸收SO3 , 目的是防止形成酸雾便于SO3吸收完全
B.工业制玻璃和炼铁过程中都要加入石灰石,目的是除去杂质二氧化硅
C.工业上用金属钠与TiCl4溶液在高温下反应,目的是将金属钛从氯化物中置换出来
D.海水中提取镁的过程中加入贝壳煅烧制得的石灰,目的是将Mg2+转变成Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列事实的解释合理的是( )
A.氢氟酸可用于雕刻玻璃,说明氢氟酸具有强酸性
B.常温下浓硝酸可用铝罐贮存,说明铝与浓硝酸不反应
C.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
D.铝箔在空气中受热熔化但不滴落,说明氧化铝的熔点比铝高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸( ![]() )是一种独特的调味剂,有很强的防腐、保鲜功效.常温下乳酸为无色液体,能与水、乙醇混溶.
)是一种独特的调味剂,有很强的防腐、保鲜功效.常温下乳酸为无色液体,能与水、乙醇混溶.
(1)将铜丝在空气中灼烧至表面呈黑色,趁热伸入乳酸中,铜丝的颜色变为 , 证明乳酸分子中含有羟基.该反应的化学方程式为 .
(2)请设计实验证明乳酸分子中含有羧基: .
(3)[CH3CH(OH)COO]2Fe(乳酸亚铁)是一种常用的补铁利,可通过乳酸与碳酸亚铁反应制得.如图装置(加热和夹持装置略去)A中装有稀硫酸,烧瓶B中装有铁屑,向三颈瓶C中加人碳酸亚铁固体和乳酸溶液并加热至75℃,将A中稀硫酸滴人B中开始反应. 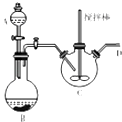
①仪器A、B组成的装置的作用是 .
②C中发生反应的化学方程式为 .
③该实验中尾气处理的方法为 .
④某兴趣小组用KMnO4滴定法测定样品中Fe2+含量进而计算产品中乳酸亚铁的质量分数,结果发现产品的质量分数总是大于100%,其原因可能是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制250mL 1.6molL﹣1的NaOH溶液,请回答下列问题:
(1)称取NaOH固体g.
(2)在配制该溶液的过程中,需经过称量、溶解、转移溶液、定容等操作,下列图示对应的操作规范是 . 根据图示,除称量外还缺少的操作步骤依次是、 . 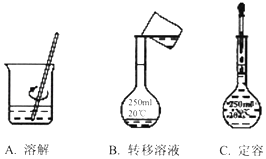
(3)在配制过程中,如果其他操作都正确,下列操作会引起NaOH溶液浓度偏低的是 .
A.称量好的固体放置一段时间后进行溶解操作
B.溶液未冷却至室温即转移到容量瓶中
C.容量瓶水洗后未干燥
D.转移溶液时不慎有少量溶液滴出瓶外
E.定容时不小心有蒸馏水滴出瓶外.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向两份30mL同一浓度的NaOH溶液中通入CO2气体,因CO2通入量的不同,溶液的组成也不同,得到溶液M、N.若向M、N溶液中逐滴加入浓度为0.25molL﹣1盐酸,产生的气体体积v(CO2)与加入盐酸的体积v(HCl)的关系分别为如图所示两种情况A和B.
请回答下列问题:
(1)NaOH溶液的物质的量浓度为 .
(2)M、N两溶液中相同组分溶质的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘元素,在实验室中,我们可以用海带通过多步实验制成碘水,下列说法正确的是( )
A.该实验过程中要用到氧化剂
B.检验碘单质是否存在,可用碘化钾溶液
C.要萃取碘水中的碘,可以用汽油或酒精
D.利用如图所示装置不能分离食盐和晶体碘的混和物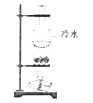
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com