
【题目】图1是丁烷(![]() )裂化的实验流程。连接好装置后,需进行的实验操作有:①检查装置的气密性、②排出装置中的空气、③给
)裂化的实验流程。连接好装置后,需进行的实验操作有:①检查装置的气密性、②排出装置中的空气、③给![]() 装置加热等。
装置加热等。![]() 后面的装置以及铁架台等已省略,
后面的装置以及铁架台等已省略,![]() 能将烃氧化成
能将烃氧化成![]() 和
和![]() 是烷烃裂化的催化剂,裂化反应有
是烷烃裂化的催化剂,裂化反应有![]() 。
。


请回答下列问题:
(1)写出甲烷与氧化铜反应的化学方程式:_________________________________。
(2)若对反应后![]() 装置中的混合物(溴水足量)按图2所示流程进行实验:
装置中的混合物(溴水足量)按图2所示流程进行实验:
①分离操作Ⅰ和Ⅱ的名称分别是________、________(填字母);
a.蒸发 b.过滤 c.分液 d.蒸馏
②![]() 溶液的作用是__________________(用离子方程式表示);
溶液的作用是__________________(用离子方程式表示);
③已知B的碳原子数大于A的碳原子数,请写出B的名称:______________________。
(3)假设丁烷完全裂化,流经D、G装置中的气体能完全反应。当E和F装置的总质量比反应前增加了![]() ,G装置的质量比反应前减少了
,G装置的质量比反应前减少了![]() ,则丁烷的裂化产物中甲烷和乙烷的物质的量之比为_______。
,则丁烷的裂化产物中甲烷和乙烷的物质的量之比为_______。
【答案】![]() c d
c d ![]() 1,2-二溴乙烷
1,2-二溴乙烷 ![]()
【解析】
丁烷从A处进入装置,通过在B中产生气泡的速率控制丁烷的通入速率,用C中的碱石灰将丁烷中混有的水蒸气除去,丁烷在D中发生裂化反应生成甲烷、乙烷、乙烯、丙烯。然后混合气体到达E中,乙烯和丙烯含碳碳双键,和溴反应生成有机物1,2-二溴乙烷和1,2-二溴丙烷留在E中,甲烷和乙烷以及未反应的丁烷通过F处理后在G中被氧化成二氧化碳和水。由此可知,E装置中主要为1,2-二溴乙烷、1,2-二溴丙烷和未反应的溴水,向混合物中加入亚硫酸钠溶液后,亚硫酸钠将溴还原留在水层里,有机层为1,2-二溴乙烷、1,2-二溴丙烷的混合物,两种都是有机物,互溶在一起,用蒸馏的方法将它们分离,得到1,2-二溴乙烷和1,2-二溴丙烷,1,2-二溴乙烷和1,2-二溴丙烷继续后续反应,据此分析解答。
(1) 由![]() 能将烃氧化成
能将烃氧化成![]() 和水可知,甲烷和CuO反应的产物有二氧化碳和水,CuO自身被还原,产物为Cu,所以甲烷和氧化铜发生反应生成二氧化碳、水和铜,化学方程式为
和水可知,甲烷和CuO反应的产物有二氧化碳和水,CuO自身被还原,产物为Cu,所以甲烷和氧化铜发生反应生成二氧化碳、水和铜,化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)①由分析可知:操作I、操作Ⅱ分别是分液、蒸馏,故答案为:c;d;
②![]() 有还原性,溴有氧化性,在E中
有还原性,溴有氧化性,在E中![]() 溶液和溴单质发生氧化还原反应,反应的离子方程式为
溶液和溴单质发生氧化还原反应,反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
③由上面的分析可知:A和B为1,2-二溴乙烷和1,2-二溴丙中的一种,已知B的碳原子数大于A的碳原子数,可知B为:![]() ,名称为:1,2-二溴丙烷,A为
,名称为:1,2-二溴丙烷,A为![]() ,名称为:1,2-二溴乙烷,故答案为:1,2-二溴乙烷;
,名称为:1,2-二溴乙烷,故答案为:1,2-二溴乙烷;
(3)溴易挥发,所以F的作用是吸收溴、水蒸气,当E和F装置的总质量比反应前增加了![]() ,说明乙烯和丙烯的质量为
,说明乙烯和丙烯的质量为![]() 。设
。设![]() 的物质的量为
的物质的量为![]() 的物质的量为y,则根据丁烷裂化方程式可知
的物质的量为y,则根据丁烷裂化方程式可知![]() 的物质的量为
的物质的量为![]() 的物质的量为y,所以
的物质的量为y,所以![]() 。根据方程式分析可知,G中减少的质量实际上就是生成物二氧化碳和水中O原子的质量。再根据氧原子守恒可知,C2H6、CH4与氧化铜反应需要的氧原子的物质的量为
。根据方程式分析可知,G中减少的质量实际上就是生成物二氧化碳和水中O原子的质量。再根据氧原子守恒可知,C2H6、CH4与氧化铜反应需要的氧原子的物质的量为![]() ,解得
,解得![]() ,则丁烷的裂化产物中甲烷和乙烷的物质的量之比为:0.005mol:0.01mol=1:2,故答案为:1:2。
,则丁烷的裂化产物中甲烷和乙烷的物质的量之比为:0.005mol:0.01mol=1:2,故答案为:1:2。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】依据反应2NaIO3+5SO2+4H2O=I2+3H2SO4+2NaHSO4,并利用下列装置从含NaIO3的废液中制取单质碘的CCl4溶液并回收NaHSO4。

其中装置正确且能达到实验目的的组合是( )
A.①②③④B.①②③
C.②④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G(分子式为C13H18O2)是一种香料,如图是该香料的一种合成路线。

已知:①E能够发生银镜反应,1 mol E能够与2 mol H2完全反应生成F;
②R—CH=CH2![]() R—CH2CH2OH;
R—CH2CH2OH;
③有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰;
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链。
回答下列问题:
(1)用系统命名法命名有机物B:________________。
(2)E的结构简式为_______________________。
(3)C与新制Cu(OH)2反应的化学方程式为________________。
(4)有机物C可与银氨溶液反应,配制银氨溶液的实验操作为__________。
(5)已知有机物甲符合下列条件:①为芳香族化合物;②与F互为同分异构体;③能被催化氧化成醛。符合上述条件的有机物甲有________种。其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6∶2∶2∶1∶1的有机物的结构简式为____________________。
(6)以丙烯等为原料合成D的路线如下:

X的结构简式为________,步骤Ⅱ的反应条件为_________,步骤Ⅳ的反应类型为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中发生反应:2NO2(g)![]() N2O4(g) ΔH=-a kJ/mol(a>0),设NA为阿伏加德罗常数的值。下列说法错误的是( )
N2O4(g) ΔH=-a kJ/mol(a>0),设NA为阿伏加德罗常数的值。下列说法错误的是( )
A.平衡后升高温度,容器中气体颜色加深
B.每消耗44.8 LNO2,生成N2O4的分子数一定为NA
C.该容器中气体质量为46 g时,原子总数为3NA
D.若N2O4分子数增加0.5NA,则放出0.5a kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用乙醇制备溴乙烷:CH3CH2OH+HBr![]() CH3CH2Br+H2O,但通常采用溴化钠和浓硫酸与乙醇共热的方法。下面是某同学对该实验的猜想,你认为可能错误的是( )
CH3CH2Br+H2O,但通常采用溴化钠和浓硫酸与乙醇共热的方法。下面是某同学对该实验的猜想,你认为可能错误的是( )
A.制备过程中可能看到有气泡产生
B.可以将适量的NaBr、H2SO4(浓![]() 、CH3CH2OH三种药品置入一种容器中加热制备CH3CH2Br
、CH3CH2OH三种药品置入一种容器中加热制备CH3CH2Br
C.如在夏天做制备CH3CH2Br的实验,实际收集到的产物可能较少
D.为了除去CH3CH2Br中混有的HBr,可用热的NaOH溶液洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(CH3COO)2Mn·4H2O主要用于纺织染色催化剂和分析试剂,其制备过程如图。回答下列问题:
步骤一:以MnO2为原料制各MnSO4

(1)仪器a的名称是___,C装置中NaOH溶液的作用是___________。
(2)B装置中发生反应的化学方程式是___________。
步骤二:制备MnCO3沉淀
充分反应后将B装置中的混合物过滤,向滤液中加入饱和NH4HCO3溶液,反应生成MnCO3沉淀。过滤,洗涤,干燥。
(3)①生成MnCO3的离子方程式_____________。
②判断沉淀已洗净的操作和现象是___________。
步骤三:制备(CH3COO)2Mn·4H2O固体
向11.5 g MnCO3固体中加入醋酸水溶液,反应一段时间后,过滤、洗涤,控制温度不超过55℃干燥,得(CH3COO)2Mn·4H2O固体。探究生成(CH3COO)2Mn·4H2O最佳实验条件的数据如下:

(4)产品干燥温度不宜超过55℃的原因可能是___________。
(5)上述实验探究了___________和___________对产品质量的影响,实验l中(CH3COO)2Mn·4H2O产率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洛匹那韦(Lopinavir)是抗艾滋病毒常用药,在“众志成城战疫情”中,洛匹那韦,利托那韦合剂被用于抗新型冠状病毒(2019-nCoV)。洛匹那韦的合成路线可设计如图:

回答下列问题:
(1)A的化学名称是_______;A制备B反应的化学方程式为_________(注明反应条件)。
(2)D生成E的反应类型为_____;F中能与氢气发生加成反应的官能团名称为___。
(3)C的分子式为_____;一定条件下,C能发生缩聚反应,化学方程式为_____。
(4)K2CO3具有碱性,其在制备D的反应中可能的作用是______。
(5)X是C的同分异构体,写出一种符合下列条件的X的结构简式______。
①含有苯环,且苯环上的取代基数目≤2
②含有硝基
③有四种不同化学环境的氢,个数比为6:2:2:1
(6)已知:CH3COOH![]() CH3COCl,(2,6-二甲基苯氧基)乙酰氯(
CH3COCl,(2,6-二甲基苯氧基)乙酰氯(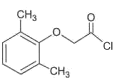 )是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
)是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为部分一氯代烷的结构简式和沸点数据,下列对表中物质与数据的分析归纳,错误的是( )
物质代号 | 结构简式 | 沸点/℃ |
① |
|
|
② |
| 12.3 |
③ |
| 46.6 |
④ |
| 35.7 |
⑤ |
| 78.44 |
⑥ |
| 68.2 |
⑦ |
| 52 |
A.物质①②③⑤互为同系物
B.一氯代烷同分异构体的沸点随着支链的增多而升高
C.一氯代烷的沸点随着碳原子数的增多而升高
D.物质⑤与⑦互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种蓝色晶体[可表示为MxFey(CN)6],经X射线研究发现,其晶体中阴离子的最小结构单元如图所示。它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上,则下列说法正确的是( )
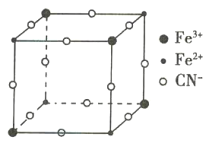
A.x=2,y=1
B.该晶体属于离子晶体,M呈+1价
C.M的离子不可能在立方体的体心位置
D.该晶胞中与每个Fe3+距离最近且相等的CN-有3个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com