
| A. | 直链烷烃中,碳原子数越多沸点越高 | |
| B. | 碳原子数相同的烷烃,支链越多沸点越高 | |
| C. | 相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃 | |
| D. | 碳原子数相同的醇,羟基越多沸点越高 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
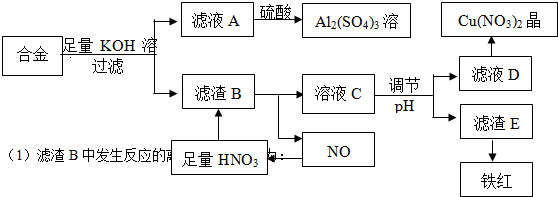
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子2个碳原子和4个氢原子不可能在同一个平面内 | |
| B. | 乙烯分子中键角约为109°28′,所有原子在同一个平面内 | |
| C. | 乙烯分子中碳碳双键的键能比乙烷分子中碳碳单键的键能小 | |
| D. | 乙烯比乙烷活泼,说明碳碳之间的π键比σ键键能小,易发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  酚类-OH 酚类-OH | B. |  羧酸-CHO 羧酸-CHO | ||
| C. | CH3CH=CHCH=CH2 烯烃 C=C | D. | CH3-O-CH3 醚类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{16}$O和${\;}_{8}^{18}$O中子数相同,质子数不同,互为同位素 | |
| B. | ${\;}_{9}^{19}$F-微粒质量数为19,电子数为9 | |
| C. | Na2O2晶体中阳离子与阴离子个数比为2:1 | |
| D. | MgCl2晶体中存在既存在离子键又存在共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com