
(7分) 由Cl-、Br-、CO32-、SO32-、SO42-、Na+、Fe3+中若干种离子组成的化合物溶于水后得无色溶液,然后依次进行实验,观察到的现象记录如下:
①向溶液中加足量新制饱和的氯水,溶液变黄,无气体产生,再加入汽油振荡,静置,汽油层呈橙红色,用分液漏斗分离。
②向分液后所得的水溶液中加入BaCl2和盐酸的混合溶液,有白色沉淀产生,过滤。
③在滤液中加入AgNO3和HNO3的混合液,有白色沉淀产生。
请认真分析后回答下列问题:
(1)原溶液中是否含有Na+ (填“是”“否”或“无法确定”,下同。),原溶液中是否含有Cl- 。
(2)步骤①中溶液变黄的原因是(用离子方程式表示):
______________________________________________________________________。
(3)原溶液中是否含有SO32-、SO42-: (填“都有”、“都没有”、“仅有一种”或“至少有一种”)。理由是_____________________________________________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(8分)室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(0C)
随加入盐酸体积变化曲线如右图所示。
(1)下列有关说法正确的是___________
A.a点由水电离出的C(H+)=10-14mol/L
B.b点:
C.c点:C(Cl-)=C(NH4+)
D.d点后,容易温度略下降的主要原因是NH3·H2O电离吸热
(2)在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”);
(3)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序,对应溶质的化学式和
溶液的pH。试填写表中空白:
|
| 离子浓度的关系 | 溶质 | 溶液的pH | 物料守恒关系 |
| ① | C(NH4+)>C(Cl-)>C(OH-)>C(H+) |
| pH>7 | / |
| ② |
| NH4Cl | / |
|
| ③ | C(Cl-)>C(H+)>C(NH4+)>C(OH-) |
| pH<7 | / |
查看答案和解析>>
科目:高中化学 来源:2010年重庆市西南师大附中高一下学期期中考试化学试题 题型:填空题
(7分) 由Cl-、Br-、CO32-、SO32-、SO42-、Na+、Fe3+中若干种离子组成的化合物溶于水后得无色溶液,然后依次进行实验,观察到的现象记录如下:
①向溶液中加足量新制饱和的氯水,溶液变黄,无气体产生,再加入汽油振荡,静置,汽油层呈橙红色,用分液漏斗分离。
②向分液后所得的水溶液中加入BaCl2和盐酸的混合溶液,有白色沉淀产生,过滤。
③在滤液中加入AgNO3和HNO3的混合液,有白色沉淀产生。
请认真分析后回答下列问题:
(1)原溶液中是否含有Na+ (填“是”“否”或“无法确定”,下同。),原溶液中是否含有Cl- 。
(2)步骤①中溶液变黄的原因是(用离子方程式表示):
______________________________________________________________________。
(3)原溶液中是否含有SO32-、SO42-: (填“都有”、“都没有”、“仅有一种”或“至少有一种”)。理由是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省南昌二中高二上学期期末考试化学试卷 题型:填空题
(8分)室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(0C)
随加入盐酸体积变化曲线如右图所示。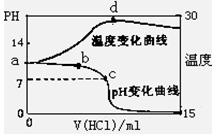
(1)下列有关说法正确的是___________
A.a点由水电离出的C(H+)=10-14mol/L
B.b点:
C.c点:C(Cl-)=C(NH4+)
D.d点后,容易温度略下降的主要原因是NH3·H2O电离吸热
(2)在滴加过程中,水的电离程度的变化是先 后 (填“增大”、“减小”或“不变”);
(3)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序,对应溶质的化学式和
溶液的pH。试填写表中空白:
| | 离子浓度的关系 | 溶质 | 溶液的pH | 物料守恒关系 |
| ① | C(NH4+)>C(Cl-)>C(OH-)>C(H+) | | pH>7 | / |
| ② | | NH4Cl | / | |
| ③ | C(Cl-)>C(H+)>C(NH4+)>C(OH-) | | pH<7 | / |
查看答案和解析>>
科目:高中化学 来源:2010年重庆市高一下学期期中考试化学试题 题型:填空题
(7分) 由Cl-、Br-、CO32-、SO32-、SO42-、Na+、Fe3+中若干种离子组成的化合物溶于水后得无色溶液,然后依次进行实验,观察到的现象记录如下:
①向溶液中加足量新制饱和的氯水,溶液变黄,无气体产生,再加入汽油振荡,静置,汽油层呈橙红色,用分液漏斗分离。
②向分液后所得的水溶液中加入BaCl2和盐酸的混合溶液,有白色沉淀产生,过滤。
③在滤液中加入AgNO3和HNO3的混合液,有白色沉淀产生。
请认真分析后回答下列问题:
(1)原溶液中是否含有Na+ (填“是”“否”或“无法确定”,下同。),原溶液中是否含有Cl- 。
(2)步骤①中溶液变黄的原因是(用离子方程式表示):
______________________________________________________________________。
(3)原溶液中是否含有SO32-、SO42-: (填“都有”、“都没有”、“仅有一种”或“至少有一种”)。理由是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2010年福建省厦门市高三上学期10月月考化学卷 题型:填空题
5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂等。(本题共7分)
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与SO2反应制得。请写出反应的离子方程式:
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+ +Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子的物质的量是_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com